Genele au nevoie de embrioni?
Există o altă situație ciudată care face dificilă înțelegerea naturii dezvoltării individuale a animalelor. Ea este faptul că etapele timpurii ale ontogeniei, ca regulă, merg deloc fără participarea genelor, cu genomul complet deconectat.
Gândește-te ce înseamnă. La urma urmelor, se presupune că dezvoltarea individuală - o „implementare“ graduală a informațiilor genetice, care este conținut în genomul unui ovul fertilizat (zigotul) și care, în final definitiv „încorporată“ în structura organismului adult. Toată lumea înțelege că drumul de la genotip la fenotip este dificil și sinuos, dar puțini evolutionistii serios încearcă să explice caracteristicile cheie ale evoluției proceselor complexe de auto-organizare, care constituie esența ontogenezei (sarcină prea dificilă). Prin urmare, de obicei, încearcă să simplifice problema prin reducerea tuturor la întrebarea de modul în care aceste sau alte modificări ale genotipului (de exemplu, mutatii) pot fi reflectate în dezvoltarea embrionului.
Genomul este în mod tradițional considerat un principiu activ (în el totul este "codificat", el "ghidează" dezvoltarea). Fătul în curs de dezvoltare, pe de altă parte, este considerat un fel de "rezultat" pasiv al activității genomului. Chestiunea este complicată oarecum de faptul că genomul în sine în timpul ontogeniei clar autosuficienta: în diferite celule ale embrionului unele gene incluse, altele off în succesiune strict determinată, în special, semnale chimice schimbate între celule și țesuturi de embrioni. Oricine conduce, nu devine clar. Unii teoreticieni pe această temă spune chiar că genomul - nu este un „program de dezvoltare a fătului“, ci mai degrabă un set de instrumente care utilizează embrionul (sau nu utilizați) pe cont propriu.
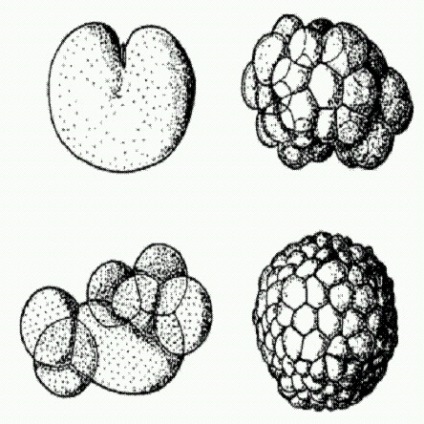
Oulul separator (partea stângă sus), o morula sub forma unei bucăți de celule (stânga inferioară), o blastură sub forma unei bile goale (dreapta inferioară și superioară). În toate aceste etape ale dezvoltării animalelor, genomul nu funcționează, de obicei. Figura prezintă evoluția meduzei Aequorea.
Pentru a-și controla propriile gene, fătul folosește o varietate de mecanisme diferite: regulamentul transcripției (citirea genelor) cu ajutorul ARN-ului mic și a proteinelor speciale de reglementare - factorii de transcripție
Un alt factor care face teza dubioase de condiționare și univocă ontogeneza genomului unui zigot, este faptul că, așa cum sa menționat mai sus, marea majoritate a animalelor nu funcționează în stadii incipiente de dezvoltare a genomului. Este pur și simplu dezactivată, toate genele sunt silențioase și ARN-ul matricei ("citit" de la genele matricei pentru sinteza proteinelor) nu sunt produse.
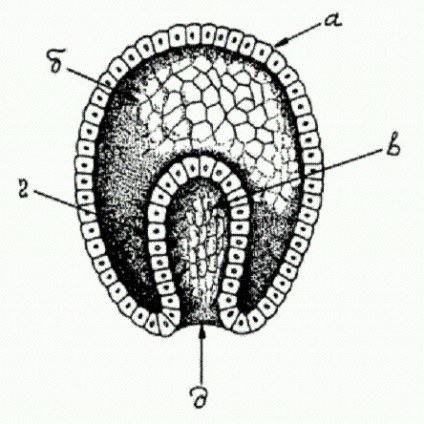
Tipic gastrula animal multicelulare, și - ectoderm (frunză embrionară exterior), - un blastocoel (cavitate a corpului primar) într-un - intestin primar, g - endodermului (piece nucleaŃie intern) d - blastopore (gura primară).
Embrionul suferă transformări complexe. Ou începe să se rupă în sus, numărul celulelor fetale crește exponențial: 2, 4, 8, 16, 32. În sfârșit, mingea este format dintr-un singur strat de celule (blastula). Celulele situate la unul din polii blastula migrează spre interior, dând naștere la un al doilea strat de germeni (endoderm), din care mai târziu se dezvoltă intestin. În acest stadiu, un embrion cu două straturi este numit gastrula. Numai în acest stadiu, în multe animale, genele moștenite de la papă împreună cu mama încep să fie incluse în cele din urmă. În altele, acest lucru se întâmplă puțin mai devreme - în stadiul de blastule. Numai mamiferele - un grup, unic în mai multe moduri - includ genele tale, chiar inainte (de exemplu, mouse-ul se face pe scenă două celule) (O altă caracteristică unică a mamiferelor - dezvoltarea puternică a „imprinting genomice“, mecanismul prin care părinții în mod intenționat o influență proprietăţile ereditare ale embrionului, în parte - pentru propriile lor interese egoiste (a se vedea capitolul 8), este posibil ca între aceste două caracteristici există o legătură Părinții pot fi interesați de faptul că „editat“ de ei ... genele embrionului au fost activate mai devreme).
Răspunsul la prima întrebare este mai mult sau mai puțin clar. Oul conține un număr mare de ARN matricial, moștenit de la corpul mamei. Aceste mARN-uri sunt citite din gene materne cu mult înainte, în timpul maturării oului. Ele asigură sinteza proteinelor necesare pentru etapele timpurii ale ontogenezei. La un moment dat, mRNA matern începe să fie distrusă. Acest lucru se întâmplă doar atunci când fătul începe să producă mRNA în sine, adică include genele sale. Acest proces destul de rapid de înlocuire a mRNA matern cu embrionul pe cont propriu se numește tranziție materno-zygotică (MZT).
Mai puțin clar este chestiunea a ceea ce conduce procesul MZT. Există trei mecanisme posibile. 1. Pe măsură ce numărul de creștere de celule embrionare constând începe să afecteze lipsa de substanțe (oricare ar fi ele de ei înșiși și nici nu este reprezentat), care nu permit embrionul să se alăture gene. stadiile timpurii ale animalelor embriogenezei nu sunt numite în mod accidental „strivire“: acesta este zdrobit zigot, celulele embrionare după fiecare diviziune devin mai mici ca diviziuni celulare între etapa offline a creșterii celulelor. Cantitatea totală de citoplasmă nu crește, în timp ce numărul de nuclee celulare și, prin urmare, ADN crește exponențial. Dacă presupunem că oul este pre-aprovizionat cu unii inhibitori de transcriere, valoarea acestor inhibitori ipotetice care pot fi atribuite fiecărei celule ar trebui să scadă rapid, iar în cele din urmă ei rămân atât de mici încât nu pot controla transcrierea.
2. Nu este exclus faptul că în zigot există inițial o blocare orientată a unor gene-cheie, ale căror activități inițiază transcripția. Astfel, sa demonstrat că introducerea artificială a activatorilor puternici de transcripție (factori de transcripție ai unui "spectru larg de acțiune") în embrion poate provoca incluziunea prematură a embrionilor parțiali premature.
3. În cele din urmă, o secvență rapidă de diviziuni celulare în sine poate interfera cu transcripția. La urma urmei, fiecare diviziune trebuie să fie precedată de dublarea ADN-ului (replicare). În cursul fragmentării, replicarea trebuie să aibă loc de fapt în mod continuu. În același timp, se știe că replicarea ar putea interfera cu transcriere, si in timpul diviziunii celulare (mitoza) se poate produce ruperea și distrugerea ARNm, a căror sinteză încă nu sa încheiat. Poate că celulele embrionului pur și simplu nu au fizic timp să-și transcrizeze genele? Încetinirea artificială a procesului de fragmentare poate duce la încorporarea prematură a genomului embrionar. Apropo, la mamifere, fragmentarea se desfășoară relativ încet, nu este aceasta explicația pentru includerea timpurie a genelor embrionare?
Cu toate acestea, niciuna dintre aceste teorii nu explică totalitatea faptelor disponibile. De exemplu, ei nu pot explica de ce nu sunt incluse toate genele embrionare simultan, dar treptat, într-o ordine strict definită.
Al doilea aspect important al MZT este distrugerea ARNm-ului matern. Aici, după cum sa dovedit, totul este stipulat în prealabil: mARN-urile materne sunt etichetate cu o secvență specială de nucleotide localizate pe "coada" netranslatată (adică, non-codificatoare) a acestor molecule. Printre primele gene pe care embrionul le include în procesul MZT se numără genele proteinelor specifice și ARN-uri mici care recunosc această secvență, se atașează la aceasta și astfel inițiază distrugerea mRNA-urilor materne.
Înainte de a înțelege pe deplin toate aceste procese, știința este încă foarte departe, dar lucrurile se mișcă. Atunci când mecanismele de bază ale reglementării genelor în timpul ontogenei timpurii vor fi descifrate, biologii vor putea să se ocupe de următoarea problemă fundamentală, adică de ce este necesar acest lucru? De ce animalele nu își încredințează controlul genomului în stadiile incipiente ale dezvoltării și apoi dintr-o dată dintr-o dată "trec" de la mARN-ul matern la propriile lor?
Apropo, această problemă are nu numai valoare teoretică, dar și practică. Dificultățile întâmpinate în clonarea animalelor sunt în mare măsură determinate de faptul că încă știm foarte puțin despre activitatea genelor în cursul dezvoltării timpurii. Clonarea animalelor se realizează prin transplantarea nucleului din celula somatică (non-sexuală) a unui animal în ovulul celuilalt. Cu toate acestea, pentru dezvoltarea normală, este necesar ca genele embrionului să fie inițial mutate și sunt destul de active în nucleul donatorului. Citoplasma oului ar trebui să "reprogrameze" nucleul, să oprească genomul și, la momentul potrivit, să îl întoarcă. Deși nu știm cum să o ajutăm, este dificil de așteptat un mare succes în clonare.
Mecanismul de regenerare a membrelor este rezolvat. "Programul genetic" al dezvoltării individuale este foarte strâns legat de un alt "program", pe baza căruia are loc regenerarea - vindecarea rănilor și creșterea părților pierdute ale corpului. Studiind regenerarea, oamenii de știință pătrund simultan în misterele ontogeniei și invers.
Biologii din Spania și Statele Unite, a efectuat recent o serie de experimente de inginerie genetică, în urma cărora au reușit să demonstreze că regenerarea membrelor în vertebrate se află sub controlul acelorași proteine de reglementare care guvernează dezvoltarea membrelor în embrion. Proteinele în cauză, formează cascada două semnal de reglementare, numit Wnt / beta-catenin (rolul de proteine Wnt in vierme Caenorhabditis elegans de dezvoltare a menționat mai sus privind „Dezvoltarea viermele începe să coada“) și BMP (elementul-cheie din titlu cascadă - proteină BMP, proteine morfogenetice osoase).
Pentru primul experiment, oamenii de stiinta au creat un virus special, in genomul in care a fost inserata o proteina care blocheaza activitatea cascadei Wnt. Introducerea virusului axolotl a redus capacitatea de regenerare. În axolotl, membrele tăiate sunt complet restaurate, dar în axolotii infectați cu virusul artificial, în loc de labuș, a crescut doar un ciocan îndreptat fără degete.
Acest experiment a arătat că funcționarea normală a cascadei Wnt este o condiție necesară pentru regenerare, dar este și ea o condiție suficientă? Pentru a testa acest lucru, oamenii de știință au creat un experiment pe o broască țestoasă, care, spre deosebire de axolotl, are capacitatea de a se regenera numai în mormoloci, iar cu vârsta această abilitate este pierdută. Un alt virus a fost produs care produce o proteină beta-catenină, unul dintre participanții-cheie la cascada Wnt. Introducerea acestui virus a îmbunătățit abilitatea broaștelor de rădăcină de a regenera membrele la acele etape de dezvoltare, când această abilitate este deja slăbită. Cu toate acestea, în broaștele adulte, pierdut complet abilitatea de a regenera, acest lucru nu a fost observat. Prin urmare, pentru regenerare, este nevoie de altceva, cu excepția cascadei Wnt.
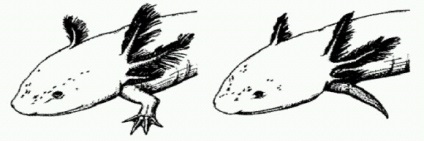
În mod normal, regenerată după amputare, finețea axolotlului (stânga) și finitețea subdezvoltată a individului, care a fost administrată de Axin1, un inhibitor al cascadei Wnt.
Cel de-al treilea obiect experimental a fost un zebră (Danio rerio). În mod normal, acest pește poate re-crește aripioare pierdute. Anterior, s-a arătat că diferiți inhibitori de cascadă Wnt reduc această abilitate (precum și în axolotl și broda shport). Pentru a testa daca activarea cascadei Wnt poate imbunatati abilitatea de a se regenera in zebra, cercetatorii au folosit pestele care a pierdut aceasta abilitate ca rezultat al mutatiei. Introducerea unui astfel de virus beta-catenin de pește a condus la o "corecție" parțială a acestui defect. Pe zebră, cercetătorii au putut, de asemenea, să demonstreze că, în plus față de cascada Wnt, semnal-regulamentul cascadă BMP ar trebui să funcționeze corect pentru o regenerare reușită.
Cel mai interesant lucru este că ambele cascade (Wnt și BMP) conduc direct la dezvoltarea membrelor în embrioni. La nivelul țesutului celular, ambele procese - regenerarea și dezvoltarea membrelor în embriogeneză - sunt, de asemenea, foarte asemănătoare. Toate aceste date indică faptul că restabilirea membrelor pierdute se realizează pe baza aceluiași program de dezvoltare care ghidează formarea membrelor în embrion. Și acest program, aparent, poate fi inclus în mod artificial chiar și în acele animale care, în mod normal, nu reușesc să restaureze deloc membrele pierdute. La urma urmei, programul de dezvoltare embrionară este la toată lumea!
Oamenii de știință au reușit să confirme această ipoteză în experimentele pe un embrion de pui. Îndepărtarea unui epiteliu multistrat special situat la vârful rudimentului aripii duce la subdezvoltarea aripii. Cu toate acestea, sa dovedit că dacă gena beta-catenină este activată într-un pui, aripa se dezvoltă mult mai bine după o astfel de amputare.
Cercetătorii au făcut o concluzie prudentă din toate acestea că cascadele de control al semnalului care controlează dezvoltarea embrionului au devenit probabil "materia primă" pe baza căreia, la unele animale, capacitatea de regenerare a fost dezvoltată. Este posibil ca studiul suplimentar al acestor sisteme de reglementare să permită, în viitor, "includerea" regenerării la animalele adulte complet lipsite de capacitatea de a restabili părțile pierdute ale corpului, inclusiv oamenii.