Masa moleculară a hidrogenului sulfurat
Hidrogenul sulfurat (monosulfan) în condiții normale este un gaz incolor.
Este instabil din punct de vedere termic. Structura moleculei este prezentată în Fig. 1.Doza este solubilă în apă rece. O soluție saturată (0,1 M) se numește "apă cu sulfură de hidrogen", care devine tulbure când stă în aer. Acesta prezintă proprietăți slabe ale acidului. În OVR este un agent puternic de reducere.
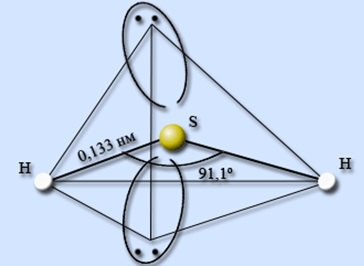
Fig. 1. Structura moleculei hidrogen sulfurat cu unghiul de valență între legături și lungimea legăturilor chimice.
Formula moleculară a hidrogenului sulfurat - H2 S. După cum se cunoaște, greutatea moleculară a moleculei este suma maselor relative atomice ale atomilor care cuprind molecula (valorile masei atomice relative luate din Mendeleev Tabelul periodic sunt rotunjite la întregi).
Mr (H2S) = 2 x Ar (H) + Ar (S);
Mr (H2S) = 2 × 1 + 32 = 2 + 32 = 34.
Masa moleculară (M) este masa de 1 mol de substanță. Este ușor de a arăta că valorile numerice ale M masa molară și masa moleculară relativă Mr sunt egale, dar prima valoare are dimensiunea [M] = g / mol, și un al doilea adimensionale:
Aceasta înseamnă că masa molară de hidrogen sulfurat este de 34 g / mol.
Exemple de rezolvare a problemelor
Asigurați formula hidrogen, sulf și oxigen, în cazul în care fracțiile masice ale elementelor în ea: w (H) = 2,04%, ω (S) = 32,65%, ω (O) = 65,31%.
Fracțiunea de masă a elementului X din molecula compoziției HX se calculează după următoarea formulă:
ω (X) = nx Ar (X) / M (HX) x 100%.
Să denotăm numărul de elemente moleculare care compun compusul pentru x (hidrogen), y (sulf), z (oxigen). Apoi, raportul molar va arăta astfel (valorile masei atomice relative luate din tabelul periodic al DI Mendeleev sunt rotunjite la întregi):
x: y: z = ω (H) / Ar (H). ω (S) / Ar (S). ω (O) / Ar (O);
x: y: z = 2,04 / 1. 32,65 / 32: 65,31 / 16;
x: y: z = 2,04. 1,02: 4,08 = 2,14.
Prin urmare, formula pentru combinarea hidrogenului, sulfului și oxigenului va avea forma H2S04. Este acid sulfuric.
Formulează formulele a două oxizi de cupru, dacă fracțiile de masă ale cuprului din ele sunt 79,9% și 88,8%.
Fracțiunea de masă a elementului X din molecula compoziției HX se calculează după următoarea formulă:
ω (X) = nx Ar (X) / M (HX) x 100%.
Să găsim fracția de masă în fiecare dintre oxizii de cupru:
ω1 (O) = 100% - ω1 (Cu) = 100% - 79,9% = 20,1%;
ω2 (O) = 100% - ω2 (Cu) = 100% - 88,8% = 11,2%.
Să denotăm numărul de moli ai elementelor care compun compusul pentru x (cupru) și y (oxigen). Apoi, raportul molar va arăta astfel (valorile masei atomice relative luate din tabelul periodic al DI Mendeleev sunt rotunjite la întregi):
x: y = 79,9 / 64. 20,1 / 16;
x: y = 1,25. 1,25 = 1.
Aceasta înseamnă că formula pentru primul oxid de cupru va avea forma CuO.
x: y = 88,8 / 64. 11,2 / 16;
x: y = 1,39. 0,7 = 2.
Prin urmare, formula celui de-al doilea oxid de cupru va avea forma de Cu20.