CONDUCTIVITATEA ELECTRICĂ A SOLUȚIILOR
Conductivitatea electrică c este o cantitate fizică scalară introdusă pentru a cuantifica capacitatea unui conductor de a trece curentul și este egală cu raportul curentului I din conductor cu tensiunea U la capetele acestui conductor
c este reciprocitatea rezistenței electrice c = 1 / R. Dimensiunea sa este [Om - 1] = [Vezi - Siemens].
Conductivitatea este o cantitate extinsă, adică în funcție de dimensiunile conductorului. Pentru a exclude dimensiunile conductorului și a cuantifica capacitatea conductorului de a trece curentul, se introduce o cantitate fizică scalară, conductivitatea k. egală cu raportul dintre produsul de conductivitate c al conductorului și lungimea lui l la secțiunea transversală S a conductorului:
Din formula (1.2) rezultă că dimensiunea specifică a conductivității [cm × m -1 sau Ohm -1 × cm -1].
Dependența conductivității specifice a soluțiilor apoase ale anumitor electroliți asupra concentrației este prezentată în Fig. 1.1. Așa cum se poate vedea din fig. 1.1, 0 pentru valoarea c ® electrolit conductivitate se apropie de valoarea conductivității apei pure, care este de aproximativ 10 - 5 × A se vedea m - 1, și datorită prezenței ionilor H3 O + și OH -. Disocierea apei rezultată: 2H2O = H3O + + OH -. Pe măsură ce concentrația electrolitului crește, conductivitatea crește mai întâi, ceea ce este asociat cu creșterea numărului de ioni din soluție și apoi scade. Cu cât mai mulți ioni din soluție, cu atât mai puternică este interacțiunea ion-ion, ceea ce duce la o schimbare în structura soluției, la încetinirea mișcării ionilor. De aceea, dependența conductivității soluțiilor apoase de electroliți de concentrație poate fi caracterizată printr-un maxim. Uneori, datorită solubilității limitate, este fixată numai ramura ascendentă a curbei (Figura 1.1).
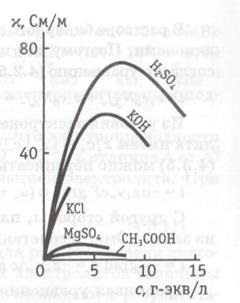
Fig. 1.1. Dependența conductivității specifice
soluții apoase de electroliți puternici din concentrație
Conductivitatea electrică echivalentă a electrolitului l este egală cu raportul dintre conductivitatea soluției și concentrația soluției exprimată în kilograme echivalentă a substanței dizolvate pe m 3:
unde l este conductivitatea electrică echivalentă a soluției [Cm × m 2 × kg-eq-1]; k este conductivitatea electrică specifică a soluției; c - concentrație (kg-eq m-3); Vo = c - 1 este diluția.
Dacă folosim dimensiunea conductivității electrice specifice [k] - [cm × cm-1], concentrația [s] - [g-eq × l-1], atunci
Infinitul soluția diluată se caracterizează prin valoarea limită a lo echivalentă conductivitate electrică atunci când a = 1, care este suma conductivitatea echivalentă a ionilor individuali: cationi - anioni și -:
Proprietatea aditivității conductivității electrice limitate, exprimată prin ecuația (1.5), este cunoscută drept legea mișcării independente a ionilor Kohlraus.
Ioni de natură chimică diferită au valori diferite ale conductivității electrice echivalente (Tabelul 1). După cum se poate observa din tabel. 1, o valoare maximă conductivitate electrică echivalentă caracterizată printr-un ion de hidrogen, un ceva mai mic - ion hidroxid conductivitate electrică echivalentă într-o soluție apoasă de alți ioni nu diferă între ele și sunt în intervalul de 40-80 cm x 2 cm x g-eq - 1.
Conform teoriei disocierii electrolitice Arrhenius pentru soluții de electroliți slabi:
unde a este gradul de disociere a unui electrolit slab; l este conductivitatea electrică echivalentă a soluției electrolitice, pentru care a este determinată; 10 este conductivitatea electrică echivalentă a unei soluții infinit diluate.
Pentru soluțiile diluate de electroliți puternici, dependența l de concentrație este aproximată cu exactitate de ecuația empirică Kohlrausz:
unde l - conductivitate electrică echivalentă a soluției de electrolit, lo - soluție echivalentă infinit diluată conductivitate electrică, b - coeficient empiric c - eq concentrație x L - 1.
Cu câteva excepții, conductivitatea specifică a soluțiilor apoase de electroliți crește odată cu creșterea temperaturii și este descrisă în mod satisfăcător prin ecuația:
unde k25 este conductivitatea la 25 ° C; t este temperatura la care se calculează conductivitatea kt; k este coeficientul de temperatură al conductivității.
Valorile limită ale conductivității electrice echivalente a diferitelor ioni în apă la o temperatură de 25 ° C
. Cm × g 2 × g-ech-1
Valoarea coeficientului de temperatură poate fi calculată pe baza măsurării conductivității soluției electrolitice la două temperaturi, de exemplu la 25 și 75 ° C.
Măsurarea rezistenței electrice a soluției electrolitice în practica de laborator se realizează utilizând o punte AC la o frecvență de 50 Hz, o diagramă schematică a căreia este prezentată în Fig. 1.2. În forma sa cea mai simplă, podul conține patru rezistoare: Rx este rezistența vasului la electrolitul examinat, Rm este rezistența depozitului de rezistență și rezistențele R1 și R2. Într-o diagonală a circuitului podului, este pornit un indicator de osciloscop zero 0 de tipul INO-3M, iar în cealaltă - o sursă de curent alternativ.
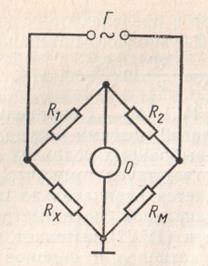
Fig. 1.2. Schematic al punții AC pentru măsurare
rezistența electrică a soluțiilor
Echilibrarea pod efectuat cu ajutorul indicatorului tub oscilografice zero, ISE-3M în plăci deflectoare pe verticală, în care este aplicată o tensiune pe diagonală și plăcile de deflexie orizontale - tensiune de alimentare de pod. Pe ecranul unui tub catodic se trasează o elipsă luminată. În cazul în care soldul podului curent diagonală este elipsă minimă se micșorează la o linie, iar relația următoare:
Dacă celula de conductivitate pentru măsurarea rezistenței soluției de electrolit au secțiunea transversală de 1 cm2 și electrozii ar ocupa toată secțiunea navei și situat la o distanță de 1 cm unul de altul, rezistența electrolitului Rx. măsurată într-un astfel de vas, ar fi numeric egală cu rezistența sa r. Astfel, am putea calcula imediat conductivitatea electrică specifică a soluției electrolitice ca inversă a rezistivității :. Pentru a produce dimensiunea celulei exacte vedere tehnic este dificil, astfel încât, în practică, utilizat pentru măsurarea rezistenței celulei electrolitice soluție de formă arbitrară și dimensiuni, în funcție de conductivitatea soluțiilor de electroliți și concentrațiile acestora (fig. 1.3). În acest caz, conductivitatea electrică specifică se calculează cu formula:
unde K este un coeficient de proporționalitate, numit constanta navei.
Rezultă din (1.10) că
Valoarea lui K depinde de distanța dintre electrozii, în zona și locația lor față de pereții vasului, precum și de volumul soluției luate. În cazul special, când electrozii ocupă întreaga secțiune a vasului, constanta K este egală cu raportul dintre distanța dintre electrozi și aria lor:
În acest caz, o navă constantă poate fi determinată prin măsurarea directă a l și S. Este această tehnică utilizată Kohlrausch, care cu mare precizie un număr de electroliți conductivitate definită (KCl, NaCl, KNO3 și colab.).
În practica de laborator, constanta celulară este determinată prin măsurarea rezistenței unui anumit volum de electrolit cu o conductivitate electrică specifică cunoscută. Valoarea K este calculată din ecuația (1.11).
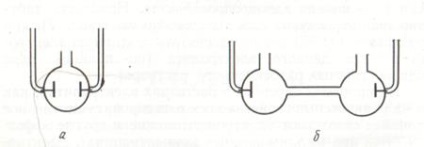
Fig. 1.3. Conductivitate măsurarea celulelor pentru măsurare
rezistența soluțiilor de electroliți care au
(a) și conductivitatea electrică ridicată (b)