Definiția și formula de zinc
Sub formă de substanță simplă, zincul este un metal alb argintiu, cu o nuanță albăstrui, dar în aer umed se acoperă treptat cu un film de oxizi și își pierde strălucirea.
La temperatura camerei este destul de fragilă, dar la 100-150 o C se îndoaie bine și se rostogoleste în foi. Metal foarte sczut. Densitatea este de 7,1 g / cm3. Punctul de topire este de 419,5 ° C, cu punct de fierbere de 906 ° C.

Fig. 1. Zinc. Aspect.
Formula chimică a zincului
Denumirea chimică a zincului este Zn din cuvântul latin "zincum". Acest element chimic este situat în a patra perioadă din grupul IIB din tabelul periodic. Universitatea Mendeleev. Se referă la elementele familiei p. Metal. Masa atomică relativă a zincului este de 65,382 amu.
Formula electronică a zincului
Nucleul atomului de zinc conține 30 de protoni și 35 de neutroni (numărul de masă este de 65). Există patru niveluri de energie în atomul de zinc, pe care sunt localizați 30 de electroni (figura 2).
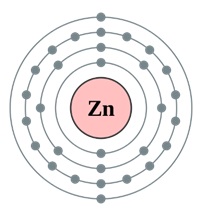
Fig. 2. Structura atomului de zinc.
Formula electronică a atomului de zinc în starea de bază are următoarea formă:
Exemple de rezolvare a problemelor
Cu arderea completă a 6 g de materie organică s-au format 8,8 g monoxid de carbon (IV) și 3,6 g apă. Determinați formula moleculară a substanței arse, dacă se cunoaște că masa molară este de 180 g / mol.
Să compunem schema de reacție de combustie a unui compus organic, care denotă numărul de atomi de carbon, hidrogen și oxigen pentru "x", "y" și, respectiv, "z"
Vom determina masele elementelor care alcătuiesc această substanță. Valorile maselor atomice relative, luate din tabelul periodic Mendeleev, rotunjit la numere întregi: Ar (C) = 12 amu. Ar (H) = 1 amu Ar (O) = 16 amu.
Se calculează masa molară de dioxid de carbon și apă. După cum se știe, masa molară a unei molecule este egală cu suma masei atomice relative a atomilor care alcătuiesc molecula (M = Mr):
M (CO2) = Ar (C) + 2 x Ar (O) = 12 + 2 x 16 = 12 + 32 = 44 g / mol;
M (H2O) = 2 x Ar (H) + Ar (O) = 2 x 1 + 16 = 2 + 16 = 18 g / mol.
m (C) = [8,8 / 44] x 12 = 2,4 g;
m (H) = 2 x 3,6 / 18 x 1 = 0,4 g.
m (O) = m (Cx Hy Oz) - m (C) -m (H) = 6 - 2,4 - 0,4 = 3,2 g.
Definiți formula chimică a compusului:
x: y: z = m (C) / Ar (C). m (H) / Ar (H). m (0) / Ar (O);
x: y: z = 2,4 / 12: 0,4 / 1: 3,2 / 16;
x: y: z = 0,2. 0.4. 0,2 = 1: 2.
Prin urmare, formula cea mai simplă pentru compusul CH2O și o masă molară de 30 g / mol [M (CH2O) = Ar (C) + 2x Ar (H) + Ar (O) = 12 + 2x1 + 16 = 12 + 2 + 16 = 30 / mol].
Pentru a găsi formula adevărată a unui compus organic, găsim raportul dintre masele moleculare reale și cele obținute:
Substanța / M (CH20) = 180/30 = 6.
Prin urmare, indicii atomilor de carbon, hidrogen și oxigen ar trebui să fie de 6 ori mai mari, de exemplu, formula substanței va avea forma C6H12O6. Aceasta este glucoza sau fructoza.