Sponsorul principal al concursului este compania Genotec.
Licitația a fost susținută de RVC.
Sponsorul nominalizării "Bioinformatică" este Institutul de Bioinformatică. Sponsor al premiului de simpatie publica a fost compania Helicon. Premiul este, de asemenea, acordat de Fundația pentru susținerea biotehnologiilor avansate.
Nu este întotdeauna cel mai bun pe rezultatele simulare pe calculator ( «in silico» [1]) molecula - candidati de droguri - poate fi o „pastila miraculoasa“, de exemplu, din cauza insolubilității lor, sterică (spațială) restricții privind legarea de molecula țintă ( de obicei, o proteină) sau protejarea unui brevet de lider. Chiar și în aceste condiții potențial medicament poate să nu reușească studiile clinice din cauza problemelor cu livrare la țesuturi și organe afectate. Este prea devreme pentru a rupe în jos și eliminat din organism, nu atinge obiectivul. Reactivitatea încrucișată - o altă problemă în a face medicamente. Acesta se află în faptul că moleculele de medicamente potențiale de multe ori pot interacționa nu numai cu obiectivul vizat de noi, dar, de asemenea, la alte proteine din organism. În acest caz, efectele secundare pot fi chiar mai periculos decât boala în sine.
Designul modern de droguri și designul de tragere
Dragul de design, sau design rațional de medicamente, este un domeniu în curs de dezvoltare în mod activ de cercetare. Bazele acestei direcții sunt bine prezentate în limba rusă în articolul lui Anton Chugunov "Drag design: cum se creează noi medicamente în lumea modernă" [2]. Pentru multe boli nu sunt suficient de eficiente de droguri, molecula de cale candidat la piața farmaceutică durează zece ani, și crearea unui droguri în valoare de mai multe miliarde de dolari [3]. Bazele de date (de exemplu, PubChem.ChEMBL.ZINC) conțin zeci de milioane de compuși chimici. Pentru a testa experimental dacă fiecare moleculă este un remediu pentru orice boală este practic o sarcină imposibilă. De aceea este necesar să se efectueze o selecție primară în acest spațiu vast de compuși chimici "in silico". pe baza structurilor și proprietăților lor cunoscute. Există multe abordări diferite pentru aceasta, de exemplu, andocarea moleculară [4] și dinamica moleculară [5]. Moleculara andocare - metoda de simulare moleculara care permite de a prezice cea mai bună poziție a ligandului (de obicei, o moleculă mică) în raport cu proteina țintă utilizând structura lor tridimensională și performanța funcției energetice interacțiunea moleculelor. dinamică moleculară se bazează pe energia potențială pentru a calcula ecuațiile de mișcare a atomilor și a funcțiilor empirice ale interacțiunilor interatomice și să descrie evoluția sistemului molecular în timp.
Selectarea țintelor
Înainte de a căuta un remediu pentru o boală, trebuie să înțelegeți baza moleculară a dezvoltării sale. Studiați cauzele și aflați interacțiunile dintre proteinele cheie. Astfel, putem descrie evoluția bolii la nivel molecular cu ajutorul unei cascade de reacții *. Acest lucru este necesar pentru a determina care proteinele sunt obiectivele cele mai promițătoare (obiective pe care trebuie să acționeze pentru a corecta sau de a compensa pentru încălcarea care a cauzat boala).
* - Apropo, în practica modernă biologia sistemelor de înregistrare a reacțiilor și a tuturor etapelor ierarhii ale proceselor biochimice și biologice devine din ce mai frecvente [6]. Ed.
Ce ar trebui să fie luate în considerare la modelare, sau de unde fac căile
Ne imaginăm că puterea noastră de calcul este incredibil de mare, și putem testa, evalua legarea de energie, cum să interacționeze cu molecula aproape toate cunoscute de mici pentru o proteină țintă (de fapt, nu este așa). Să presupunem că, în urma acestei examinări, am selectat un număr de molecule care au demonstrat cele mai bune rezultate. Crezi că toți ar putea deveni droguri? Pentru a răspunde la această întrebare, nu efectuează experimente cu celule și, în plus, corpul, trebuie să fie testate în continuare în silico. Să ne amintim că o moleculă mică trebuie să satisfacă derivat empiric „regula de cinci“ Lipinski (au mai puțin de cinci atomi donori de legături de hidrogen, au o greutate moleculară mai mică de 500, au lipofilicitate (log P - coeficientul de distribuție substanță la partiția de apă-octanol) mai mică de 5; nu au mai mult de 10 atomi de azot și oxigen) [2]. De asemenea, nu se poate uita despre caracteristicile metabolice (ADMET: absorbția, distribuția, metabolismul, excreția, toxicitate). Pe lângă toate acestea, este necesar ca molecula candidat a fost capabil să interacționeze în spațiu cu centrul activ al țintei și satisface constrângerile sterica. Se poate ca molecula activă este potențial prea mare și nu poate „ajunge“ la site-ul activ al țintei, sau are o structură complicată, din cauza care este foarte dificil și costisitor de a sintetiza. În mod alternativ, molecula este foarte mică și „universal“ - atunci interacționează nu numai cu obiectivele noastre, dar, de asemenea, cu multe alte proteine din corpul uman. Acest lucru duce la efecte secundare, care pot fi foarte grave. Imaginea nu este foarte fericit, și modul în care medicamentele de pe piață tot mai confuze. „Din moment ce toate curbele sunt trase în fața mea, căi ocolite surde.“ - în conformitate cu Yosano Akiko, poet japonez. Ei bine, există modalități de a ajuta evita confuzia în aceste căi ocolite trageți de design.
Schimbarea scheletului
Când ați găsit un candidat de droguri molecula, aveți nevoie pentru a optimiza și de a îmbunătăți proprietățile sale, pentru a crește probabilitatea de succes în verificarea experimentală. Având în vedere molecula candidat (ligand), putem identifica este important pentru a interacționa cu partea de proteine țintă a cadrului structural - scheletul - și a altor grupuri, probabil nu sunt implicate în interacțiunea de interes pentru noi, sau chiar preveni contactul cu ligandul țintă. Schimbarea scheletului (schelă hopping) este necesară atunci când vrem să salvați importante pentru interacțiunea cu ținta ligandului și celălalt pentru a înlocui mai adecvată. Desigur, este necesar, în acest caz, să se ia în considerare schimbarea ligandului de energie de legare la țintă. În plus, proprietățile conformaționale ale ligandului sunt modificate, care afectează interacțiunea entropiei.
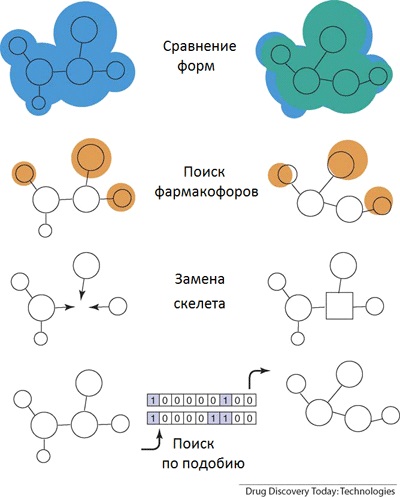
Figura 1. Principiul "schimbării scheletului": coincidența formelor, căutarea unor grupuri speciale care definesc proprietățile, scheletul în sine, căutarea în asemănare. O imagine din [11].
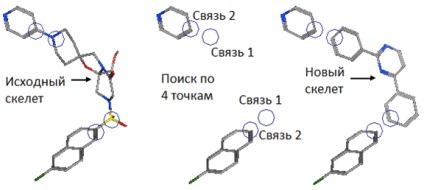
Figura 2. Moleculele și moleculele originale sunt rezultatul unei schimbări de schelet. O imagine din [12].
Dacă schimbați scheletul vom obține o mulțime de opțiuni noi, printre care alege cele mai bune, cele mai potrivite pentru structura de noi tridimensională, entropia de legare a energiei la proteina țintă, precum și alte caracteristici. Schimbarea scheletului ligandului extinde câmpul de posibilități, ne oferă multe variații. Ca și cum am avea un set de piese de designer, și vrem să obținem niște structuri ordonate și stabile (folosind aceste fragmente și unele link-uri le), apoi să-l atașați la orice altceva. Ca și cum am pierdut o piesă extremă a puzzle-ului, dar știm ce ar trebui să fie în locul în care se alătură imaginii, ceea ce o face completă. Astfel, putem, de exemplu, dintr-un ligand mare și trudnosinteziruemogo pentru a face un mic, bine capabil de a face drumul lor spre site-ul de legare. Este ca și cum ai tăia piesa de bucăți din piesa de puzzle din carton, aruncând tot ce este de prisos.
Există o altă zonă interesantă de aplicare a modificării scheletului asociată cu așa-numitele brevete avansate. Astfel de brevete sunt emise de ceva timp pentru companiile care pretind că există o anumită activitate medicamentoasă într-o anumită moleculă. În acest timp trebuie să demonstreze că această activitate există. Și ce faci dacă ați găsit activitatea acestei molecule și doriți să o brevetați? Când faceți o schimbare de schelet, rezultatul este o altă moleculă, care nu este acoperită de un brevet, dar care posedă o activitate biologică interesantă [7, 9-11].
Căutarea unor molecule similare utilizând farmacofora
Un farmofor este un set de semnale spațiale și electronice necesare pentru a oferi interacțiuni optime cu o țintă biologică care poate provoca sau bloca răspunsul său biologic. Astfel de semne pot fi hidrofobicitatea, aromatizarea, proprietățile donor-acceptor, încărcătura. Putem folosi căutarea farmacoforului în screening-ul virtual (computer) al bazelor de date mari, biblioteci de compuși chimici. Această abordare este utilă în special atunci când nu avem suficiente informații despre structura țintei și setul de liganzi pentru utilizarea metodelor de modelare bazate pe utilizarea structurilor tridimensionale.
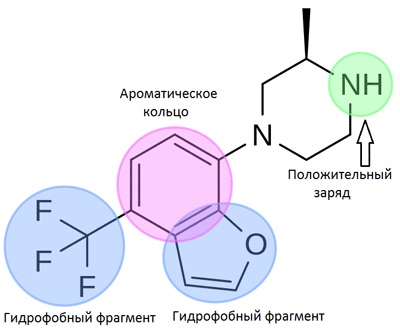
Figura 4. Un exemplu de model tri-dimensional de farmacofor. Imagine de pe Wikipedia.
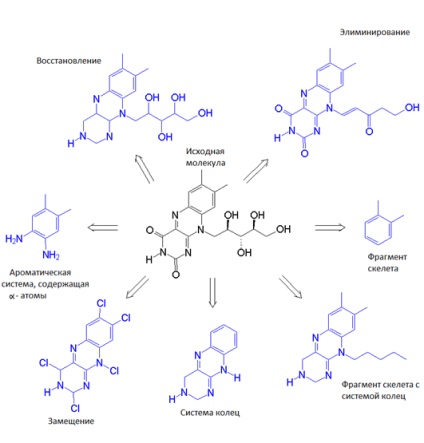
Figura 5. Rezultatele căutării pentru similaritatea moleculară. Imagine: Manualul WODCA.
Căutați după asemănarea moleculară
Molecule structurale similare au de obicei proprietăți biologice similare. Acesta este principiul asemănării moleculare. Să presupunem că știm că o anumită activitate de ligand interacționează cu o țintă, dar din diferite motive (interacțiunea cu alte proteine ale organismului si toxicitate, proprietati Admet depreciate, protecție de brevet) nu pot fi folosite de noi ca un nou medicament. Apoi, putem căuta imaginea și să găsească un molecule ligand adecvat, care apoi sunt mai susceptibile de a deveni droguri.
Concluzie sau ce ar trebui să învățăm pentru a crea un tratament?
Un exemplu al unei abordări integrate a design de droguri este opera lui Bergman si colegii sai, care se numește «SHOP: schela țopăit de căutări similaritate GRID pe bază» [16]. Se utilizează metode de schimbare scheletic, căutarea de similaritate, de andocare moleculare și unele calcule matematice. Țintele pentru demonstrarea metodei au fost luate de trombină, proteaza HIV-1 si neuraminidaza (membrana virală proteină având activitatea enzimatică, una dintre proteinele cheie ale virusului gripei si o tinta buna pentru tragere de proiectare, căutarea inhibitorilor ea a început în 1966). În crearea de medicamente, rolul norocului, al șanselor și al probabilității este mare. Acesta este motivul pentru care putem folosi metode mai avansate și "trasee de ocolire" atunci când molecula candidatului "ghicit" nu este ideală. Vedem că o putem îmbunătăți, vrem ceva mai mult și putem realiza acest lucru.
"Deschiderea este ca sa te indragostesti si sa ajungi in varful muntelui dupa o urcare grea. "A spus Max Ferdinand Perutz, biochimist englez, câștigător al Premiului Nobel din 1962 [8].
mulțumesc
Pete Vlasov, care mi-a deschis ocazia să mă ocup de proiectarea dragonilor; Natalia Kireeva, care citește cursuri excelente despre chemoinformatică la MIPT (SU); Fedra Kondrashov și Dinara Usmanova, care mă inspiră să fac știință.
Citirea ulterioară
literatură
Ați putea fi, de asemenea, interesat
De la epoca pietrei până în secolul al XIX-lea, numărul omenirii a rămas aproximativ același, situație în care doi copii au supraviețuit până la vârsta de reproducere. Exact trăit - de obicei născut cu o duzină, dar cel mai mult a pierit, fără a lăsa urmașii - clasicul teoriei selecției naturale. În acest caz, oamenii au murit rareori din colții lupilor sau tigrilor - majoritatea morții au provocat boli, față de care eram la fel de lipsiți de apărare ca și "frații noștri mai mici". Până au apărut vaccinurile. În acest articol, nu vom intra în teoria imunizării, ci vom încerca să răspundem în limbajul uman preocupărilor oamenilor cu privire la vaccinări.