Puritatea soluțiilor este importantă pentru întregul proces hidrometalurgic. Când instalația funcționează pe soluții curate, consumul de energie pe tonă de zinc este redus, productivitatea echipamentului este mărită, procesele de sedimentare și filtrare sunt îmbunătățite, iar costul de producție este redus.
Impuritățile prezente în soluții, în funcție de metoda de purificare de la acestea, pot fi împărțite în următoarele grupuri:
1) fier, aluminiu, cupru, arsenic, antimoniu, germaniu, indiu, galiu, silice;
2) cupru, cadmiu, cobalt, taliu;
3) cobalt, clor, fluor;
4) potasiu, sodiu, magneziu, mangan.
Impuritățile primului grup sunt eliminate din soluție prin hidroliză, coprecipitare, adsorbție și coagulare. Purificarea din impuritățile celui de-al doilea grup se bazează pe procesul de deplasare electrochimică cu mai multe metale negative. Pentru al treilea grup de impurități, se folosesc metode chimice de curățare pentru a forma compuși care sunt insolubili în soluții apoase. Impuritățile celui de-al patrulea grup se acumulează în soluții și se eliberează de ele numai prin eliminarea unei părți a soluției din ciclul de producție.
Din cele de mai sus este clar că cuprul și cobaltul pot fi îndepărtate din soluție în diferite moduri.
Conceptul de purificare "hidrolitică" include metode de purificare bazate pe hidroliză și precipitarea impurităților, pe măsură ce pH-ul pulpei crește.
Purificarea hidrolitică este de obicei combinată cu leșierea cimentului și are loc în timpul neutralizării acidului. Această metodă elimină impuritățile care precipită din soluție la valori scăzute ale pH-ului decât pentru hidroxidul de zinc.
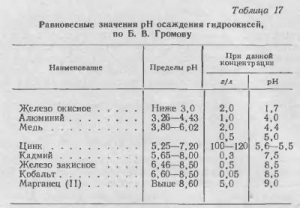
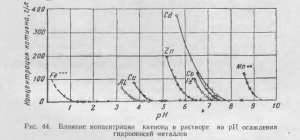
Precipitarea hidroxizilor are loc la un anumit pH, care, la rândul său, depinde de concentrația cationului din soluție, de temperatura și de puterea ionică a soluției. Cele mai complete studii de hidroliză efectuate săruri ale metalelor grele BV Gromov În lucrarea sa, el citează mai mulți hidroxizi de depunere (Tabelul. 17) Efectul concentrației metalului în pH-ul de precipitare hidroxid este prezentată în Fig. 44.
După cum se vede din datele de mai sus, suspensia la un conținut de zinc neutru de 100-120 g / litru sunt pH = 5,6 / 5,5, în care fier, aluminiu, cupru și alte metale având un pH mai mic de 5,6 precipitații, picătură din soluție .
Fierul este într-o soluție acidă sub formă de sulfat de FeSO4 peroxid și sulfat de oxid Fe2 (SO4) 3. Concentrația de fier trivalent datorată prezenței agenților reducători în pasta acidă este întotdeauna mai mică decât cea a bivalentului. Componentele din fier sunt hidratate prin reacții
Hidratul de oxid feros este oxidat rapid, cu un conținut de oxigen liber în soluția de hidroxid
4Fe (OH) 2 + 02 + 2H20 = 4Fe (OH) 3.
De fapt, în procesul de leșiere a cărămizii, principalele sulfați de fier sunt precipitate, deoarece hidroxizii sunt precipitați în formă pură numai din soluții foarte diluate. Fier fier în condiții de leșiere neutre se hidrolizează într-o măsură nesemnificativă. Pentru a finaliza precipitarea fierului, este necesar să-l transformați într-o formă de oxid.
Oxidarea fierului se realizează prin trei metode, minereul de mangan, oxigenul în aer și compușii de cupru.
Pyrolusitul, conținut în minereul de mangan, oxidează fierul într-un mediu acid prin reacție
2FeSO4 + Mn02 + 2H2S04 = Fe2 (SO4) 3 + MnS04 + 2H20.
Unele plante pentru oxidarea cantităților mici de fier folosesc permanganatul de potasiu. Oxidarea continuă conform ecuației
10FeSO4 + 2KMnO4 + 8H2S04 = 5Fe2 (SO4) 3 + K2S04 + 2MnS04 + 8H2O.