Tema: "STRUCTURA ȘI FUNCȚIILE PROTEINELOR COMPLEXE. STRUCTURA ȘI FUNCȚIILE MYOGLOBINEI ȘI HEMOGLOBINE »
1. Definiția conceptului și a principiilor de bază ale clasificării proteinelor complexe. Exemple.
2. Glicoproteine: caracteristici ale structurii, exemple, funcții. Imunoglobuline: trăsături structurale, clase de imunoglobuline, rolul lor în organism.
3. Phosphoproteins: reprezentanți, legarea grupului protetic cu apoproteină, rol în organism.
4. Metalloproteine: reprezentanți, natura grupului protetic, legarea acestuia la apoproteină, rolul metaloproteinelor în organism.
5. Structura și funcția cromoproteinelor (de exemplu, myoglobina și hemoglobina). Proprietățile alosterice ale hemoglobinei. Efectul cooperativ. Rolul ionilor de hidrogen CO 2 și al 2,3-difosfogliceratului în reglarea afinității hemoglobinei pentru oxigen.
6. hemoglobină (deoxyhemoglobin, oxihemoglobină, karbgemoglobin, carboxihemoglobina, methemoglobină, cyanmethemoglobin), caracteristicile acestora. Cauzele și consecințele acumulării methemoglobinei în sânge.
7. Formele moleculare de hemoglobină. Hemoglobina fetală, trăsături structurale, proprietăți, rol biologic. Celule hemoglobinei hemoglobinei (HbS), caracteristici structurale, proprietăți, manifestări ale hemoglobinei S.
Conceptul de proteine simple și complexe. Clasificarea proteinelor complexe.
3.2.1 Lipoproteinele sunt proteine complexe care conțin ca lipide de grup protetic și derivați ai acestora. Reprezentanții sunt chilomicroni și alte fracțiuni de lipoproteine din sânge. Lipoproteinele sunt forme de transport ale lipidelor în sânge. Această clasă de proteine complexe este discutată mai detaliat în secțiunea "Metabolismul lipidic".
3.2.2 Nucleoproteinele sunt proteine complexe care conțin acizi nucleici ca grup protetic. Nucleoproteinele sunt viruși, ribozomi, cromatina nucleului celular. Există două tipuri de nucleoproteine: 1) ribonucleoproteine. care includ acidul ribonucleic (ARN); 2) deoxiribonucleoproteinele. care include acidul dezoxiribonucleic (ADN). Structura și proprietățile acizilor nucleici vor fi luate în considerare ulterior.
O caracteristică a porțiunii de proteine a nucleoproteinelor este aceea că conține multe reziduuri de aminoacizi încărcate pozitiv. Astfel, deoxiribonucleoproteinele includ proteine histone, bogate în lizină și arginină. Între proteine și componente non-proteine ale nucleoproteinelor se formează legături ionice (deoarece acizii nucleici sunt încărcați negativ).
3.2.3. Fosfoproteinele conțin în compoziția lor reziduuri de acid fosforic, legate cu reziduuri de hidroxaminoacid (serină, treonină) cu ajutorul legăturilor de ester. La acest grup de proteine complexe se află cazeinogenul din lapte, ovalbumina și vitellina. Multe proteine intracelulare sunt fosfoproteine. Adăugarea unei grupări fosfat la o proteină cauzează deseori o schimbare a funcției sale.
Fosforilarea și procesul invers - defosforilarea - un mecanism comun pentru reglarea activității biologice a proteinelor. De exemplu, fosforilarea histonei reduce capacitatea lor de a se lega de ADN și de a participa la reglarea sintezei de matrice care implică ADN.
3.2.4. Metaloproteinelor. Dacă proteina conține ioni ai unuia sau mai multor metale, atunci aceste proteine se numesc metaloproteine. Ionii metalici sunt legați prin legături de coordonare cu grupurile funcționale ale proteinei și participă la menținerea structurii sale spațiale. Metaloproteinele sunt adesea enzime.
Transferinul este o proteină de fier solubilă în apă, care se găsește în serul de β-globulină. Molecula de transferină conține 2 ioni Fe 3+; această proteină servește ca un purtător de fier în organism.
Feritina este o proteină globulară intracelulară, care se găsește în principal în splină, ficat, măduvă osoasă, care îndeplinește rolul depozitului de fier în organism. Datorită feritinei, depozitele de fier citosolice sunt menținute într-o formă solubilă și netoxică.
Hemosiderina. în contrast cu feritina și transferina, este un complex proteic conținând fier insolubil în apă. Se găsește în principal în celulele ficatului și splinei, se acumulează cu exces de fier în organism, de exemplu, cu transfuzii de sânge frecvente.
Ceruloplasmina este o proteină a fracțiunii de 2-globulină a serului de sânge, molecula sa conține 6-8 ioni de cupru. Are activitate catalitică, catalizează reacția de oxidare a Fe2 + în Fe 3+. Acest lucru face posibilă legarea fierului cu transferin și transportul ulterior în sânge.
Structura și funcția glicoproteinelor. Imunoglobuline.
3.3.1. Glicoproteinele - conțin ca grupuri protetice carbohidrați și derivații lor. Ei sunt atașați fie prin legătura N-glicozidică cu gruparea amido a restului de asparagină, fie prin legătura O-glicozidică cu gruparea hidroxi a restului de serină sau treonină. Porțiunea de carbohidrat are o structură neregulată.
Glicoproteine în organism funcționează următoarele funcții: structura (colagen, elastina), de protecție (anticorpi, interferoni), receptorilor, hormonali (hormoni hipofizari), enzimatice, transport.
3.3.2. Imunoglobuline (anticorpi) - un grup de proteine produse de organism ca răspuns la intrarea în structuri străine (antigene). Acestea sunt sintetizate de limfocite B sau celule plasmatice. Organismul poate produce aproximativ 107 de varietăți de imunoglobuline, fiecare dintre acestea putând recunoaște un antigen specific. Toate imunoglobulinele sunt împărțite în cinci clase: IgA, IgG, IgM, IgD, IgE.
Principala unitate structurală a imunoglobulinelor sau a monomerilor este formată din patru lanțuri polipeptidice, interconectate prin legături disulfidice, dintre care:
a) două lanțuri grele identice (greutate moleculară 53000 - 75000 Da), notate cu literele H;
b) două lanțuri ușoare identice (greutate moleculară aproximativ 23000 Da), notate cu literele L.
Imunoglobulina G, D și E în structura lor, sunt în general monomeri, molecule IgM construit din cinci monomeri, IgA pot fi fie monomeri sau compuse din două sau mai multe unități structurale.
Lanțurile de proteine care alcătuiesc imunoglobulinele pot fi divizate în mod condiționat în domenii specifice sau regiuni cu anumite caracteristici structurale și funcționale.
Secțiunile N-terminale ale lanțurilor L și H sunt denumite regiunea variabilă (V), deoarece structura lor este caracterizată prin diferențe semnificative în diferitele clase de anticorpi. În domeniul variabil, există 3 regiuni hipervariabile care diferă în cea mai mare diversitate a secvenței de aminoacizi. Este regiunea variabilă a anticorpilor care este responsabilă de legarea antigenelor în conformitate cu principiul complementarității; structura primară a lanțurilor de proteine din această regiune determină specificitatea anticorpilor.
Domeniile C-terminale ale lanțurilor H și L au o structură primară relativ constantă în cadrul fiecărei clase de anticorpi și sunt numite regiunea constantă (C). Regiunea constantă determină proprietățile diferitelor clase de imunoglobuline, distribuția lor în organism, poate participa la lansarea mecanismelor care provoacă distrugerea antigenilor.
3.3.3 Funcțiile imunoglobulinelor. IgG reprezintă aproximativ 75% din numărul total de imunoglobuline plasmice. IgG leagă eficient și inactivează moleculele străine și celulele care intră în organism și, de asemenea, facilitează distrugerea lor în continuare, pot depăși bariera placentară, care asigură imunitatea nou-născuților în primele săptămâni de viață.
IgA se găsesc în principal în secretele membranelor mucoase ale căilor respiratorii și ale excretorilor, tractului gastrointestinal, adică Protejați suprafețele care comunică cu mediul.
IgM sunt sintetizate în stadiile incipiente ale răspunsului imun, intră într-o reacție de aglutinare cu antigene, activează sistemul de complement.
IgD sunt legate la membrana limfocitelor, funcționează ca receptori pentru antigeni.
IgE sunt implicați în dezvoltarea reacțiilor alergice, în protecția împotriva infestărilor parazitare.
3.4.1. Printre chromoproteins distinge hemoproteins (cuprind ca grupare prostetică a derivaților porfirinici) și flavoproteinelor (conținând derivați de riboflavină - vitamina B 2). Cromoproteinele participă la realizarea multor funcții vitale, cum ar fi respirația tisulară, transferul de oxigen, reacțiile redox, percepția luminoasă, fotosinteza în celulele plantelor și alte procese.
3.4.2. La hemoproteine sunt: hemoglobina, mioglobina, citocromul, peroxidaza, catalaza. Aceste proteine conțin heme ca grup protetic.
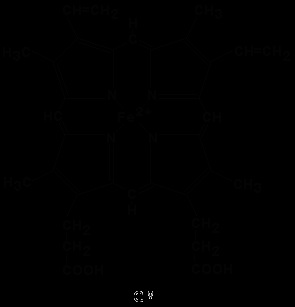
Conform structurii sale chimice, heme este protoporfirina IX. legat de fierul feros. Protoporfirina IX este un compus organic care aparține clasei de porfirine. Protoporfirina IX conține patru inele de pirol substituite legate prin punți metinice = CH-. Substituenții din inelele de pirol sunt: patru grupări metil CH3-. două grupări vinii CH2 = CH- și două resturi de acid propionic - CH2-CH2-COOH. Hemul se leagă la partea proteică după cum urmează. Grupuri non-polare. protoporfirina IX interacționează cu regiunile hidrofobe ale aminoacizilor prin intermediul legăturilor hidrofobe. În plus, există o legătură de coordonare între atomul de fier și radicalul imidazol al histidinei din lanțul proteic. O altă legătură de coordonare a atomului de fier poate fi utilizată pentru legarea oxigenului și a altor liganzi.
Prezența în materialul biologic al proteinelor care conțin hem detectată folosind proba benzidina (cyan când este adăugat benzidină și peroxid de hidrogen în soluția de testat este colorată).
3.4.3. Comparați structura și funcția de mioglobină și hemoglobină, amintiți-vă caracteristicile fiecăreia dintre aceste proteine.
Myoglobina este o cromoproteină prezentă în țesutul muscular și are o mare afinitate pentru oxigen. Greutatea moleculară a acestei proteine este de aproximativ 16000 Da. Molecula de mioglobină are o structură terțiară și este un lanț polipeptidic unic legat de hem. Myoglobinul nu are proprietăți alosterice (vezi punctul 2.4). Curba de saturație cu oxigenul său are forma unei hiperbola (Figura 4). Funcția de mioglobină este de a crea o rezervă de oxigen în mușchi, care este consumată după cum este necesar, înlocuind lipsa temporară de oxigen.
Hemoglobina (Hb) este o cromoproteină prezentă în eritrocite și implicată în transportul oxigenului în țesuturi. Hemoglobina adulților se numește hemoglobină A (Hb A). Greutatea sa moleculară este de aproximativ 65.000 Da. Moleculă Hb A are o structură cuaternară și include patru lanțuri de polipeptide - subunități (notate cu α 1 α 2 β 1 și β 2, fiecare dintre acestea asociându-se cu hema.
Amintiți-vă că hemoglobina se referă la proteine alosterice, moleculele sale putând merge în mod reversibil de la o conformație la alta. Aceasta modifică afinitatea proteinei pentru liganzi. Conformația, care are cea mai scăzută afinitate pentru ligand, se numește conformație tensiune sau T. Conformația, care are cea mai mare afinitate pentru ligand, se numește relaxare sau R-conformație.
Conformarea R și T a moleculei de hemoglobină se află într-o stare de echilibru dinamic:
Diferiți factori ai mediului pot schimba acest echilibru într-o direcție sau alta. Regulatorii allosterici care afectează afinitatea Hb la O 2 sunt: 1) oxigen; 2) concentrația H + (pH-ul mediului); 3) acid carbonic (C02); 4) 2,3-difosfogliceratul (DFG). Adăugarea unei molecule de oxigen la una din subunitățile hemoglobinei facilitează tranziția conformației tensionate la o relaxare și crește afinitatea pentru oxigen a altor subunități ale aceleiași molecule de hemoglobină. Acest fenomen a fost numit efectul de cooperare. Natura complexă a legării hemoglobinei la oxigen reflectă curba de saturație a hemoglobinei O 2. având o formă în formă de S (Figura 3.1).
Creșterea conținutului de CO 2 H +. DFG pe fundalul unei presiuni parțiale scăzute a O2 în țesuturi promovează interacțiunea acestor factori cu hemoglobina și tranziția de conformație R la conformația T. Aceasta conduce la o schimbare a echilibrului din ecuația (1) spre dreapta. O2 eliberat intră în țesuturi.
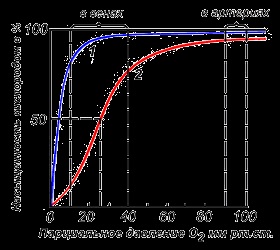
Figura 3.1. Curbele de saturație ale mioglobinei (1) și ale hemoglobinei (2) cu oxigen.
3.5.1. Sarcini.
1. Acidul fosforic se găsește în hidrolizatul unei proteine complexe. Este posibil să spun cu certitudine la ce clasă apar proteinele studiate?
2. Comparați solubilitatea grupului protetic de hemoglobină în apă și solvenți organici.
3.5.2. Standarde de decizie.
1. După cum se poate observa din Tabelul 3.1, acidul fosforic este un grup protetic de proteine din clasa fosfoproteinelor. Este, de asemenea, cunoscut faptul că fosfatul este o parte a acizilor nucleici, care pot acționa ca un grup protetic de nucleoproteine. Prin urmare, acidul fosforic poate fi găsit în hidroliza atât a fosfoproteinei, cât și a nucleoproteinei. Pentru a clarifica clasa de proteine hidrolizate, este necesar să se efectueze reacții calitative hidrolizate la bazele și pentozele azotate (vezi 3.1).
2. Solubilitatea unei substanțe în apă sau solvenți organici depinde de ce grupuri funcționale predomină în moleculă. Grupul protetic al hemoglobinei - hem - conține doar două grupe polar (două grupări carboxil), restul moleculei este nepolar (distribuție uniformă a densității electronice). Prin urmare, hemele se dizolvă bine în solvenți organici și nu se dizolvă în apă (vezi 3.2).
3. 2, 3-Difosfogliceratul (DFG) este un regulator alosteric, reducând afinitatea hemoglobinei pentru oxigen. Prin urmare, cu o creștere a conținutului DFG în eritrocite, echilibrul în ecuația de disociere a HbO 2 se schimbă spre dreapta. Creșterea eliberării de oxigen prin oxihemoglobină are o valoare compensatorie pentru organism, deoarece compensează cantitatea insuficientă de oxigen din atmosferă (vezi 3.2).