Interacțiunea intermoleculară este de natură electrică și constă în forțe atractive (orientare, inductivă și dispersantă) și forțe respingătoare.
Forțele orientale
Două dipole electrice ab și cd sunt atrase la locația mutuală indicată, deoarece încărcăturile opuse la punctele b și c interacționează mai puternic decât încărcăturile cu același nume la punctele a și c (și, de asemenea, în b și d).
Forțele orientale acționează între moleculele polare, adică posedă momente electrice dipolice. Forța de atracție dintre două molecule polare este maximă în cazul în care momentele lor dipol sunt situate de-a lungul unei linii (a se vedea figura). Această forță se datorează faptului că distanța dintre diferitele încărcări este puțin mai mică decât între aceleași. Ca urmare, atracția dipolilor depășește repulsia lor. Interacțiunea dintre dipoli depinde de orientarea lor reciprocă și, prin urmare, forțele interacțiunii dipol sunt numite orientare. Mișcarea termică haotică schimbă în mod continuu orientarea moleculelor polare, dar, după cum arată calculul, media pentru toate orientările posibile, valoarea forței are o anumită valoare care nu este egală cu zero. Energia potențială a interacțiunii intermoleculare orientale:
unde p1 și p2 sunt momentele dipol ale moleculelor care interacționează.
Corespunzător, forța de interacțiune: Fop
Forța Fore scade cu o distanță mult mai rapidă decât forța de interacțiune a corpurilor încărcate de Coulomb (Fcul
Forțe de inducție
Forțele inductive (sau polarizarea) acționează între molecule polar și nepolar. O moleculă polară creează un câmp electric. care polarizează molecula cu încărcături electrice distribuite uniform pe volum. Încărcăturile pozitive sunt deplasate în direcția câmpului electric și negative - împotriva. Ca urmare, o moleculă nepolară induce un moment dipol.
Energia interacțiunii intermoleculare în acest caz este proporțională cu momentul dipolului p1 al moleculei polar și polarizabilitatea a2 care caracterizează capacitatea celeilalte molecule de a polariza:
Această energie se numește inducție. deoarece apare datorită polarizării moleculelor cauzate de inducția electrostatică. Forțele de inducție (Găsiți
r-7) acționează de asemenea între moleculele polare.
Forțe dispersante
Între moleculele nepolare, acționează interacțiunea intermoleculară a dispersiei. Natura acestei interacțiuni a fost clarificată complet numai după crearea mecanicii cuantice. În atomi și molecule, electronii se mișcă într-un mod complex în jurul nucleelor. Pe parcursul timpului, momentele dipol ale moleculelor nepolare se dovedesc a fi zero. Dar, în orice moment, electronii ocupă o anumită poziție. Prin urmare, valoarea instantanee a momentului dipolului (de exemplu, pentru un atom de hidrogen) este diferită de zero. Un dipol instantaneu creează un câmp electric care polarizează molecule adiacente. Ca urmare, apare interacțiunea dipolilor instantanee. Energia interacțiunii dintre moleculele nepolare este rezultatul mediu al interacțiunii tuturor dipolilor instant posibili cu momente dipolice, pe care le induc în moleculele vecine datorită inducției. Energia potențială a interacțiunii intermoleculare dispersive:
a1a2 / r6 a Fdisp
r -7 (aici a1 și a2 sunt polarizabilitățile moleculelor care interacționează).
Interacțiunea intermoleculară a unui tip dat se numește dispersie, deoarece dispersia luminii în materie este determinată de aceleași proprietăți ale moleculelor ca și această interacțiune. Forțele de dispersie acționează între toți atomii și moleculele, deoarece mecanismul apariției lor nu depinde de faptul că moleculele (atomii) au momente dipol constante sau nu. De obicei, aceste forțe depășesc atât orientarea, cât și inducția. Doar în interacțiunea moleculelor cu momente mari de dipol, de exemplu moleculele de apă, Fop> Pd (de 3 ori pentru moleculele de apă). În interacțiunea dintre moleculele polare cum ar fi CO. HI. HBr și alții, forțele de dispersie sunt zeci și sute de ori superioare celorlalte.
Este foarte important ca toate cele trei tipuri de interacțiune intermoleculară să scadă în același mod cu distanța:
U = Uop + Uind + Udisp
Forțele repulsive
Forțele de repulsie acționează între molecule la distanțe foarte mici, când cochilii de electroni umpluți de atomii care alcătuiesc moleculele intră în contact. Principiul Pauli existent în mecanica cuantică interzice penetrarea învelișurilor de electroni pline unul în celălalt. Forțele repulsive care rezultă depind într-o măsură mai mare decât forțele de atracție, individualitatea moleculelor. Pentru un acord bun cu datele experimentale se presupune că energia potențială a forțelor repulsive Uot crește odată cu scăderea distanței conform legii:
Interacțiunea rezultată
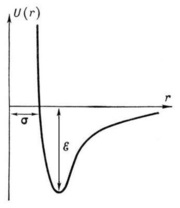
Dependența potențialului U (r) al interacțiunii intermoleculare Lennard-Jones la distanța r între molecule. Distanța r = σ este cea mai mică distanță posibilă dintre moleculele imobiliare și ε este adâncimea "puțului potențial" (energia de legare a moleculelor).
Dacă presupunem că U (r) = 0 ca r → ∞ și luăm în considerare faptul că energia de atracție scade cu o distanță descrescătoare proporțională cu r -6. iar energia repulsivă crește ca r-12. atunci curba U (r) va avea forma prezentată în figură. Minimul energiei potențiale corespunde distanței la care forțele de interacțiune ale moleculelor sunt zero.
Pentru a calcula cu suficientă precizie, U (r) pe baza mecanicii cuantice cu o mare varietate de perechi de molecule interacționate este practic imposibilă. Nu este posibil să măsuram experimental puterea interacțiunii la distanțe intermoleculare. Prin urmare, este obișnuit să selectați o astfel de formulă pentru U (r), astfel încât calculele efectuate cu aceasta să poată fi bine coordonate cu experimentul. Cel mai adesea folosiți formula:
U (r) = 4e (σ / r) 12 - (σ / r) 6)
așa-numitul potențial Lennard-Jones. Cantitățile σ și ε care intră în formula sunt determinate experimental pe baza dependenței proprietăților substanțelor (de exemplu, coeficienții de difuzie ai conductivității termice sau viscozității) pe σ și ε.
Ecuația lui van der Waals
Van der Waals a sugerat că, la distanțe mici (r), forțele de repulsie acționează între moleculele care, cu distanța în creștere, sunt înlocuite de forțe atractive. Pe baza acestor concepte, fără a lua în considerare chiar dependența cantitativă a interacțiunii intermoleculare pe distanță, el a obținut așa-numita ecuație van der Waals a stării unui gaz real.
Urmăriți ce este "interacțiunile intermoleculare" în alte dicționare:
INTERACȚIUNI INTERMOLECULARE - reciprocă. molecule între ele, ceea ce nu duce la ruperea sau formarea de agenți chimici noi. cravate. M. c. determină diferența dintre gazele reale din gazele ideale, existența lichidelor și mol. cristale. Din M. c. depinde foarte mult. structurale, spectrale, termodinamice, ... Enciclopedii chimice
INTERACȚII INVALIDE - interacțiuni ale atomilor care nu au legătură chimică. comunicare. În clasic. teoria chimică. structuri pentru geom. configurații ale moleculei aproape de echilibru, se presupune că este posibilă o separare alternativă a interacțiunilor tuturor atomilor care formează o moleculă în două ... ... Enciclopedie chimică
Forțele Van der Waals sunt forțe intermoleculare (și interatomice) van der Waals cu o energie de 10 20 kJ / mol. Acest termen a desemnat inițial toate aceste forțe, în știința modernă este obișnuit ... Wikipedia
Interacțiunea intermoleculară - Interacțiunea intermoleculară este interacțiunea dintre moleculele neutre sau atomii electrici. Pentru prima dată au fost luate în considerare de către J. D. van der Waals în 1873. Contabilitatea forțelor intermoleculare este necesară pentru a explica proprietățile gazelor reale și ... ... Wikipedia
COMPLEXELE MOLECULARE - (complexe donor-acceptor, compuși moleculari) se formează dintr-o saturație formală a valenței. molecule datorită forțelor interacțiunii intermoleculare. Sovrem. noțiunea de MK este mult mai amplă decât cea stabilită în numele lor, deoarece în MK se poate ... ... Encyclopedia chimică
INTERACȚIUNEA INTERACȚIONALĂ - interacțiunea dintre atomi atît liberi, cît și o parte a uneia sau a diferitelor molecule, cristale etc. poate fi referit ca un singur, m, n, m, m, m, m, m, m, n, și în an ... ... Enciclopedie fizică
SPECTRA MOLECULAR - spectrele de emisie, absorbție și Raman ale luminii (dispersie Raman) aparținând moleculelor libere sau slab legate. Tipic M. p. dungi, sunt observate ca o colecție de benzi mai mult sau mai puțin înguste în UV, vizibile și ... ... Enciclopedie fizică
CRISTALE MOLECULARE - sunt formate din molecule legate de forțele van der Waals (vezi Interacțiuni intermoleculare). În interiorul moleculelor, atomii sunt legați prin legături substanțial mai puternice (covalente). Transformări de faze M. topire, sublimare, tranziții polimorfe ... ... Enciclopedii chimice
Molecule - (Novolatum moleculara, diminutivul masei latinice) este cea mai mică particulă a unei substanțe care posedă proprietățile sale chimice. M. constă din atomi, mai precis din nucleele atomice, care înconjoară electronii lor interni și electroni de valență externă, ... ... Enciclopedia Sovietică Mare