În zilele noastre fizica a devenit o știință foarte comună. În sens literal, este prezent peste tot. Exemplul cel mai elementar: în curtea ta crește un măr, iar pe el se cântă fructe, vine timpul și merele încep să cadă, dar în ce direcție cad? Datorită legii gravitației universale, fructul nostru cade la pământ, adică se duce în jos, dar nu în sus. Acesta a fost unul dintre cele mai faimoase exemple de fizică, dar să fim atenți la termodinamică și, mai exact, la echilibrul de fază, care nu mai puțin importante în viața noastră.
termodinamică

În primul rând, să ne uităm la acest termen. termodynamic - acesta este cuvântul în limba greacă. Prima parte a căldurii înseamnă "căldură", iar a doua parte este "putere". Termodinamica este o ramură a fizicii care studiază proprietățile unui sistem macroscopic, precum și diferite modalități de conversie și transmitere a energiei. În această secțiune, diferite stări și procese sunt studiate special pentru a introduce conceptul de temperatură în descriere (aceasta este o cantitate fizică care caracterizează un sistem termodinamic și este măsurată cu ajutorul anumitor instrumente). Toate procesele care apar în sistemele termodinamice sunt descrise numai prin cantități microscopice (presiune și temperatură, precum și concentrația componentelor).
Ecuația Clapeyron-Clausius
Fiecare fizician știe această ecuație, dar să o analizăm în parte. Se referă la procesele de echilibru ale tranziției unei anumite materii de la o fază la alta. Acest lucru este perfect vizibil în astfel de exemple: topire, evaporare, sublimare (una dintre modalitățile de conservare a produselor, care trece printr-o îndepărtare completă a umidității). Formula arată clar procesele care au loc:
- n = PV / RT;
- unde T este temperatura substanței;
- P este presiunea;
- R este căldura specifică a tranziției de fază;
- V este modificarea volumului specific.
Istoria ecuației

Ecuația Clapeyron-Clausius este o explicație matematică excelentă a celei de-a doua legi a termodinamicii. Denumită și "inegalitatea lui Clausius". Desigur, teorema a fost dezvoltată de omul de știință, care a vrut să explice relația dintre fluxul de căldură din sistem și entropia, precum și mediul său. Această ecuație, Clausius, sa dezvoltat în încercările sale de a explica entropia și de ao determina în cantități. În sensul literal, teorema ne permite să determinăm dacă procesul ciclic este reversibil sau ireversibil. Această inegalitate ne oferă o formulă cantitativă pentru înțelegerea celei de-a doua legi.
Sistem izolat închis
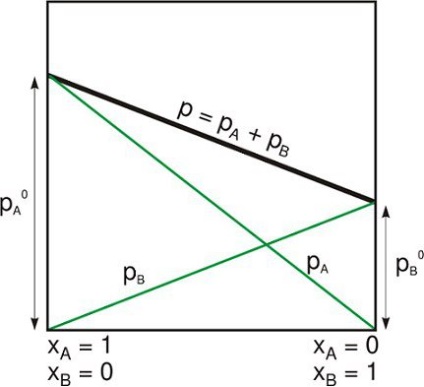
Un sistem izolat este unul dintre următoarele moduri:
- Sistemul fizic este departe de celelalte, care nu interacționează cu ele.
- Sistemul termodinamic este închis de pereți fixi rigizi, prin care nu poate trece nici materia, nici energia.
În ciuda faptului că subiectul se referă intern la propria gravitate, un sistem izolat este, de obicei, luat în afara limitelor forțelor externe gravitaționale și a altor forțe îndepărtate.
Acest lucru poate fi comparat cu ceea ce (într-o terminologie mai generală folosit în termodinamică) se numește un sistem închis, închis de pereți selectivi, prin care este posibilă transferul energiei sub formă de căldură sau de muncă, dar nu contează. Și cu un sistem deschis în care materia și energia intră sau ieșesc, deși pot avea pereți impenetrabili diferiți în anumite părți ale granițelor sale.
Sistemul izolat respectă legea conservării. Cel mai adesea în termodinamică, materia și energia sunt tratate ca concepte separate.
Terminații tranzitorii
Pentru a înțelege tranzițiile cu faze cuantice, este util să le comparăm cu transformările clasice (numite și inversări termice). CPT descrie punctul de retur în proprietățile termodinamice ale sistemului. Semnalează reorganizarea particulelor. Un exemplu tipic este tranziția înghețării apei, care descrie o transformare netedă între un lichid și un solid. Extinderea fazelor clasice se datorează concurenței dintre energia sistemului și entropia fluctuațiilor sale termice.
Sistemul clasic nu are entropie la temperatura zero și, prin urmare, transformarea de fază nu poate avea loc. Ordinea lor este determinată de primul potențial termodinamic derivat discontinuu. Și, desigur, are prima ordine. Transformările de fază de la un feromagnet la un paramagnet sunt continue și au o a doua ordine. Aceste schimbări constante de la o fază ordonată la o fază neordonată sunt descrise printr-un parametru de ordine care este zero. Pentru transformarea feromagnetică menționată mai sus, parametrul de ordine va fi magnetizarea totală a sistemului.
Potențialul Gibbs
Energia Gibbs gratuită reprezintă numărul maxim de lucrări fără expansiune care poate fi eliminat dintr-un sistem închis termodinamic (care poate schimba căldura și poate lucra cu mediul). Un astfel de rezultat maxim poate fi obținut numai într-un proces complet reversibil. Când sistemul este transformat într-o manieră inversă de la prima stare la a doua stare, scăderea energiei Gibbs libere este egală cu sistemul realizat în mediul său, minus munca forțelor de presiune.
Statele de echilibru

Echilibrul termodinamic și mecanic este un concept axiomatic al termodinamicii. Aceasta este starea internă a unuia sau mai multor sisteme care sunt conectate prin pereți mai mult sau mai puțin permeabili sau impermeabili. În această stare, nu există fluxuri macroscopice pure din materie sau energie, fie în interiorul sistemului, fie între sisteme.
În propria sa concepție despre starea echilibrului intern, nu se produce o schimbare macroscopică. Sistemele sunt situate simultan în echilibru termic, mecanic, chimic (constante), radiații. Ele pot fi într-o singură formă. În acest proces, toate speciile sunt stocate imediat și o perioadă infinită de timp până când funcționarea fizică este întreruptă. Schimburile echilibrate absolut exacte au loc în echilibru macroscopic. Dovada de mai sus este o explicație fizică a acestui concept.
Fiecare lege, teorema, formula are baza. Să analizăm cele 3 baze ale legii de echilibru de fază.
- Faza este o formă de materie, omogenă în compoziția chimică, starea fizică și echilibrul mecanic. Fazele tipice sunt solide, lichide și gazoase. Două lichide nemiscibile (sau amestecuri lichide cu compoziții diferite), separate printr-o limită separată, sunt considerate două faze diferite și particule solide nemiscibile.
- Numărul componentelor (C) este numărul componentelor independente din punct de vedere chimic ale sistemului. Numărul minim de specii independente necesare pentru determinarea compoziției tuturor fazelor sistemului.
- Numărul de grade de libertate (F) în acest context este numărul de variabile intensive care nu depind unul de celălalt.
Clasificarea prin echilibru de fază
- Reacțiile pur transferului pur (deseori numite reacții în fază solidă) apar între solide de compoziție diferită. Acestea pot include elemente găsite în lichide (H, C), dar aceste elemente persistă în faze solide, astfel încât fazele lichide (H2O, CO2) să nu fie utilizate ca reactivi sau produse. Reacțiile solide ale transferului pur pot fi continue sau intermitente, precum și cele terminale.
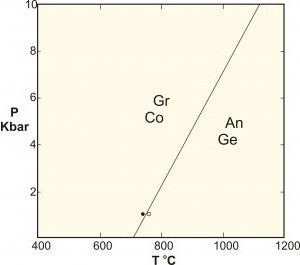
- Polimorfii sunt un tip special de reacție în fază solidă, care include faze de compoziție identică. Exemplele clasice sunt reacțiile dintre silicații aluminiu-cyanite-sillimanite-andalusite, conversia grafitului în diamant la presiune înaltă și echilibrul carbonatului de calciu.
Legile echilibrului

Norma fabricii lui Gibbs a fost sugerată de Joseph Willard Gibbs în celebrul său articol intitulat "Echilibrul substanțelor eterogene", care a fost publicat între 1875 și 1878. Se aplică la sisteme eterogene multicomponente nereactive în echilibru termodinamic și este dată de egalitate:
- F = C-P + 2;
- unde F este numărul de grade de libertate;
- C este numărul de componente;
- P este numărul de faze în echilibrul termodinamic unul cu celălalt.
Numărul de grade de libertate este numărul de variabile intensive neocupate. Cel mai mare număr de parametri termodinamici, cum ar fi temperatura sau presiunea, care pot varia simultan și arbitrar, fără a afecta reciproc. Un exemplu de sistem cu o singură componentă este un sistem cu o substanță chimică pură, iar sistemele cu două componente, precum amestecurile de apă și etanol, au două componente independente. Tranzițiile tipice de fază (echilibrul de fază) sunt solide, lichide, gaze.
Regula de fază la presiune constantă
Pentru aplicațiile din domeniul științelor materialelor legate de schimbările de fază dintre diferitele structuri solide, există adesea o presiune constantă (de exemplu, într-o atmosferă) și este ignorată ca un grad de libertate, astfel încât regula devine: F = C - P + 1.
Uneori, această formulă este introdusă sub denumirea de "regulă de fază condensată", dar, după cum știm, nu se aplică acestor sisteme supuse presiunilor mari (de exemplu, în geologie), deoarece consecințele acestor presiuni pot avea consecințe catastrofale.
Se poate părea că echilibrul de fază este doar un sunet gol și nu este suficientă în ce procese fizice este implicat acest moment, dar după cum am văzut, multe legi care ne sunt cunoscute nu funcționează fără ea, deci trebuie să vă familiarizați puțin cu aceste lucruri unice, colorate, reguli puțin plictisitoare. Această cunoaștere a ajutat mulți oameni. Ei au învățat să le aplice pentru ei înșiși, de exemplu, electricieni, cunoscând regulile de lucru cu faze, se pot proteja de pericolul inutil.
