Atunci când temperatura vaporilor de echilibru crește cu amestecul volatil de compoziție constantă, el este îmbogățit cu acea componentă a cărei căldură parțială de evaporare molară este mai mare. Această lege este valabilă pentru amestecurile volatile atât fără un azeotrop, cât și cu un azeotrop.
Când temperatura din sistem crește cu max pe curba presiunii vaporilor, compoziția vaporilor de echilibru și compoziția amestecului azeotropic se schimbă într-o direcție. În sistemul cu min, compoziția vaporilor de echilibru și amestecul azeotrop se schimbă în direcții opuse.
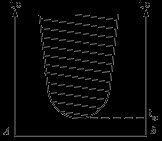
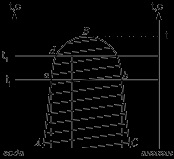
Multe lichide au o solubilitate mutuală limitată și într-un anumit interval de temperatură și compoziția atunci când sunt amestecate formează 2 faze. De exemplu, anilina-apa: AB-caracterizează modificarea solubilității anilinei în apă cu o schimbare a temperaturii. BC - caracterizează modificarea solubilității în apă în anilină cu o schimbare în T. AB și BC converg la punctul B, care se numește temperatura superioară a solubilității critice. Deasupra acestei temperaturi, volumele de lichide sunt amestecate în orice proporție. Dacă tragem o izotermă, atunci ea traversează curba ABC, apoi traversează la a și b și caracterizează compoziția stratului de apă și c - compoziția stratului anilinic. Soluțiile corespunzătoare compoziției punctelor A și B sunt numite conjugate, iar segmentul AB este numit nod. Dacă luăm amestecuri de anilină și apă cu compoziția roabei d și încălzim acest amestec la o temperatură, vom observa într-un pahar cu două faze: 1) o soluție apoasă de d1 și un alt strat de anilină. Masa fazelor conjugate ale soluțiilor poate fi determinată de regula pârghiei. Pentru a găsi temperatura de solubilitate critică, se poate folosi o regulă a diametrului rectiliniu.
5.Presurarea vaporilor saturați în sistemele cu solubilitate mutuală limitată a componentelor
În astfel de sisteme considerate, ambele straturi lichide au aceleași vapori la echilibru (prin presiunea totală a compoziției și prin presiunea parțială a componentei C).
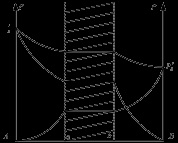
Diferența în compoziția totală a lichidului din regiunea heterogenă limitatoare înseamnă numai diferența dintre cantitatea relativă a ambelor straturi și compoziția constantă a fiecăruia dintre ele. Atât presiunea totală, cât și cea parțială a vaporilor saturați pentru întreaga regiune indicată rămâne constantă.
6.Lichide insolubile insolubile
Dacă fluidele sunt reciproc insolubile, ele formează sisteme eterogene în care fiecare componentă există independent de cealaltă. Presiunea de vapori a fiecăruia dintre componentele deasupra amestecului este egală cu presiunea de vapori a componentei pure.
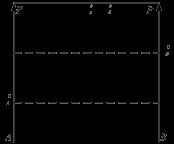
Presiunea totală de vapori a unui amestec de lichide insolubile reciproc este egală cu suma presiunilor de vapori saturate ale componentelor pure la aceeași temperatură. Prin urmare, astfel de amestecuri sunt fierte la o temperatură mai mică decât punctul de fierbere al fiecăruia dintre componente. Pe măsură ce amestecul eterogen se evaporă, punctul de fierbere rămâne constant până când este complet evaporat de unul dintre componente, după care punctul de fierbere al sistemului se schimbă discontinuu până la punctul de fierbere al componentei rămase. Acest lucru este utilizat în practica de inginerie și de laborator pentru distilarea cu abur. Compoziția vaporilor saturați nu depinde de raportul dintre componentele din lichid. care indică numărul de moli ai componentelor A și B din vapori și condensul obținut din vapori. Dacă V este o pereche, atunci se poate scrie ecuația Mend-Klap. Dacă al doilea component este apă, atunci - debitul de abur. Este mai mult, cu atât mai puțin. Distilarea cu vapori de apă este utilizată pentru a îndepărta benzenul din gudron de cărbune, pentru a purifica anilina.