Chimie și Tehnologie Chimică
Topirea are loc atunci când secțiunea transversală efectivă. cantitatea per lanț este mai mare decât este permisă de forțele de atracție intermoleculară. fixarea cristalului. [C.230]
Atunci când moleculele sunt separate de o suprafață mare de energie de la suprafață, energia totală a lichidului de evaporare este redistribuită moleculelor rapide care părăsesc spațiul gazos înconjurător. depășind forțele de atracție intermoleculară. o parte din energie este consumată pentru a realiza lucrarea de detașare, ca urmare a scăderii energiei moleculelor rămase în lichid și lichidul se răcește treptat. Pentru ca procesul de evaporare să se desfășoare la T = 1
Face raportul forță de atracție intermo alte proprietăți fluide, cum ar fi viscozitatea sau temperatura de solidificare CăutaŃi în directoare și localizați pentan, octan și decan în ordinea crescătoare a vâscozității. Profesorul vă va verifica datele. [C.184]
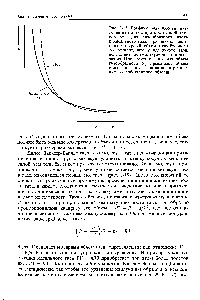
Fig. 3-18. o scădere a presiunii gazului real ca rezultat al atracției intermoleculare. [C.154]
Gazele reale au proprietăți. oarecum diferită de cele ideale, deoarece moleculele lor nu sunt de fapt mase punctuale. lipsiți de volum și deoarece aceste molecule sunt atrase unul de celălalt. atracție intermoleculară nu poate fi neglijat în condițiile în care moleculele se misca mai lent, așa cum se întâmplă la temperaturi mai scăzute, în prezența propriului său volum de molecule începe să iasă cu o compresie puternică a gazului. În consecință, proprietățile gazelor sunt mai apropiate de cele ideale la temperaturi ridicate și presiuni scăzute. [C.157]
Creșterea temperaturii împiedică forțele de atracție interatomică (intermoleculară), care contribuie la ordonarea sistemului. și întărește mișcarea haotică. adică dezagregarea particulelor. Prin urmare, la temperaturile foarte scăzute, primul trend prevalează, la temperaturile înalte predomină a doua tendință. Într-adevăr, dacă procedeele de asociere a moleculelor și sinteza substanțelor pentru implementarea lor, de regulă, necesită un regim cu temperatură scăzută, reacțiile de descompunere se produc, de obicei, la temperaturi ridicate. [C.48]
Pentru producerea numai a polimerilor cu viscozitate intrinsecă constând din macromolecule liniare forme flexibile sau puțin ramificate pot fi utilizate cu coeziune moleculară ridicată asigurând aderență puternică a macromoleculelor sub acțiunea forțelor de atracție intermoleculare. masa moleculară în intervalul 10-10-10 și o distribuție suficient de îngustă a masei moleculare. [C.410]
În funcție de magnitudinea atracției intermoleculare în sisteme nonideale, coeficienții de activitate pot fi mai mari și mai mici decât unitatea. Valoarea numerică a coeficientului de activitate este o funcție a tuturor celorlalte componente ale soluției și concentrația acestora. De exemplu, pentru componenta A într-un amestec binar, Va = b dacă x =. deoarece lichidele pure sunt considerate soluții ideale. Pe măsură ce concentrația scade, ud crește și atinge un maxim la x = 0. Aceeași dependență se observă și pentru alte componente. [C.19]
Pentru polimerii liniari, cel prezentat în Fig. 214 dependența rezistenței la tracțiune la gradul de polimerizare R. Pentru rezistența R mici este scăzută, dar crește rapid odată cu creșterea gradului de polimerizare de la 100 la 300, iar din P egal cu 400, rămâne aproape constantă. Acest lucru se datorează faptului că atunci când cantitatea mică de molecule de polimer pentru a sparge aceasta trebuie să depășească doar forțele intermoleculare relativ slabe ale atracție (molecule alunecă de-a lungul reciproc, iar atunci când lungimea lanțului de gaturi de durere. Consecință a caracteristicilor de mai sus [c.588]
Forțele de atracție intermoleculară în raport cu valorile lor absolute sunt foarte semnificative și ajung la un maxim la distanțele dintre particule mult mai mici în comparație cu dimensiunile lor. Cu mărirea dimensiunilor particulelor la distanțele corespunzătoare, forțele de atracție intermoleculară scad ușor. [C.40]
În plus, există și alte motive. provocând apariția forțelor de coeziune între particule și determinarea valorii termenului adițional To în condițiile de pierdere a stabilității stratului staționar (1.3). Aceasta, de exemplu, este umiditatea care creează punți capilare în jurul locurilor unde particulele vin în contact. Apoi electricitatea statică. care apar atunci când fricțiunea particulelor se toarnă. Pentru particule foarte mici, cu un diametru de 40-60 μm, forțele van der Waals ale atracției intermoleculare a straturilor de suprafață ale boabelor încep să joace un rol important. [C.26]
Structura polimerului descris se comportă ca o structură de coagulare. Similaritatea în comportamentul acestor structuri este că ele sunt caracterizate prin legături chimice în interiorul particulelor și printr-o ordine de mărime a interacțiunilor interparticulare mai mici. Pe măsură ce polaritatea macromoleculelor crește, flexibilitatea acestora scade și toate cele trei tipuri de forțe van der Waals devin caracteristice pentru interacțiunile intermoleculare. Prezența unor astfel de grupuri funcționale. ca OH, -COOH, -NH, cauzează formarea de legături de hidrogen mai puternice. Cu o atracție sporită intermoleculară, polimerul se transformă într-o substanță mai greu, mai puțin elastică și chiar fragilă. pierzând fuzibilitatea și solubilitatea. Polimerii cu legături chimice între macromolecule (spațial) sunt insolubile și nu se topesc atunci când sunt încălzite. Prin proprietăți ele corespund structurilor de condensare. [C.391]
Cu alte cuvinte, în termoplastice izotropice, cu o slăbire a materialului fragil, doar o mică parte (mai puțin de 1% din toate legăturile principale) se află într-o stare complet stresată. În astfel de condiții, debutul propagării unei fisuri instabile este determinat de magnitudinea atracției intermoleculare. Revenind la datele lui Vincent, trebuie spus că nu numărul legăturilor de bază pe unitate de suprafață și forța inerentă, iar magnitudinea forțelor intermoleculare determină rezistența macroscopică. Valorile de rezistență ridicate se datorează ambalării strânse. [C.83]
Dacă doi atomi diferă în capacitatea lor inerentă de a atrage electroni. adică prin electronegativitate, atunci perechea de electroni. cu ajutorul căruia se creează o legătură chimică între ele. se deplasează spre un atom cu o electronegativitate mai mare și apare o sarcină negativă. iar celălalt atom este o sarcină pozitivă. Astfel de legături și molecule, în care acestea există, sunt numite polare. Polar molecule nu sunt atrase numai de prieten, dar pot atrage, de asemenea, ioni pozitivi sau negativi. Punctele de fierbere și topire ale substanțelor cu molecule polare sunt mai mari decât se poate aștepta. judecând numai prin magnitudinea forțelor de atracție ale van der Waals, deoarece polaritatea moleculelor determină apariția forțelor suplimentare de atracție intermoleculară. [C.52]
Căldură de evaporare. mai exact, căldura totală de evaporare a lichidului. se compune din două componente: 1) energia folosită pentru depășirea forțelor de atracție intermoleculară în fluid (inclusiv asocierea), numită căldura internă a mesphering-ului și 2) energia folosită pentru depășirea presiunii externe atunci când vaporii sunt eliberați. numit căldură externă (sau muncă) de evaporare și egală cu pAv. Căldura externă este întotdeauna mult mai mică decât căldura internă. În cele ce urmează vom lua în considerare doar căldura generală de evaporare, numindu-i pentru scurtătate căldura de evaporare. [C.173]