1. Caracteristici generale ale proceselor de halogenare 4
2. Siguranța proceselor de halogenare 9
3. Tehnologia chimiei și a proceselor 10
Referințe 12
Fabricarea organicele a apărut foarte mult timp, dar inițial sa bazat pe prelucrarea materiilor prime vegetale sau animale - (. Săpun, alcool și altele) selectarea materialelor (zahar, ulei) sau separarea. Sinteza organică, adică producția de substanțe mai complexe, de la cele relativ simple, sa născut la mijlocul secolului al XIX-lea pe baza produșilor secundari ai cocsului de cărbune care conține compuși aromatici. Apoi, încă din secolul XX, atât petrolul, cât și gazul natural au început să joace un rol din ce în ce mai important ca surse de materii prime organice, extracția, transportul și prelucrarea acestora fiind mai economice decât cele pentru cărbune. Pe aceste trei tipuri de materii prime fosile se bazează în principal industria sintezei organice. In procesele de separare fizică, sau scindare catalitică termică (cocsificare, cracare, piroliză, reformare, conversie) obținute cinci grupe de materii prime pentru sinteza multor mii de alți compuși:
1. Parafine (de la metan CH4 la hidrocarburi C15-C40);
2. olefine (C2H4, C3H6, C4H8, C5H10);
3. hidrocarburi aromatice (benzen, toluen, xilen, naftalină);
5. Monoxid de carbon și gaz de sinteză (un amestec de CO și H2).
In dezvoltarea industriei sintezei organice a fost împărțită în mai multe sectoare (tehnologia dye, medicamente, materiale plastice, fibre etc.), printre care o industrie importanta loc sinteza organica si petrochimice de bază. Termenul de sinteză organică "de bază" (sau "greu") acoperă producerea de produse cu mai multe tonaj, care servesc drept bază pentru toate celelalte tehnologii organice. La rândul său, termenul „Petrochemical“ sinteza a apărut în legătură cu tehnologia de transformare a materiei organice a materiilor prime petroliere în sensul obișnuit al cuvântului (excluzând prepararea substanțelor anorganice și polimeri) se referă la rafinare chimică din petrol hidrocarburile primare derivate. În acest sens, face parte din sinteza organică de bază, care este motivul originii lor combinate.
1. Caracteristicile generale ale proceselor de halogenare
1. Derivații de halogen se obțin în trei moduri principale: substituția, adiția și scindarea.
Halogenarea substituită (substitutivă) constă în substituirea altor atomi sau grupări cu atomi de halogen. Dintre acestea, cea mai importantă este substituția atomilor de hidrogen
RH + CI2 -> RCI + HCI
care poate apărea cu atomi de carbon saturați și nesaturați sau în nucleul aromatic. Abilitatea de a înlocui este reținută în diferiți derivați de hidrocarburi.
Înlocuirea unui atom de halogen cu alta este importantă pentru producerea de derivați de fluor, brom și iod din compuși organoclorurați mai ușor disponibili:
CCI4 + 2HF - CCI2F2 + 2HCI
RCI + NaBr -> RBr + NaCI
Substituirea grupării OH pentru un atom de halogen este utilizată pentru a se obține anumiți derivați halogenați, precum și clorurile acide:
ROH + HCI → RCI + H2O
RCOOH + COCI2 - RCOCI + CO2 + HCI
Conectarea (aditiv) de halogenare - adăugarea de agenți de halogenare la compușii nesaturați este la fel de importantă ca substituția practică. Halogenii liberi pot să se alăture legăturilor C = C, C = C și Sar-Sar:
CH2 = CH2 + CI2 → CICH2-CH2CI
CH = CH + 2CI2 - CHCI2-CHCI2
C 6H 6 + 3 CI 2 → C 6H 6CI 6
Halogenurile de hidrogen sunt unite prin legături duble și triple (hidrohalogenație), iar olefinele intră și în reacția de clorhidrogenare:
CH2 = CH2 + HCI-CH3-CH2CI
CH = CH + HCI -> CH2 = CHCI
CH2 = CH2 + CI2 + H20 - CH2CI-CH2OH + HCI
Capacitatea acestor reacții de halogenare aditivă este reținută în numeroși derivați de hidrocarburi nesaturate.
Un caz special de clorurare adițională este adăugarea clorului la atomi într-o stare de valență mai scăzută, de exemplu sinteza fosgenului din monoxid de carbon și clor:
CO + CI2 → COCI2
Reacțiile de scindare a derivaților clorurii devin din ce în ce mai importante. Dintre acestea, dehidroclorurarea (1), inversul adaosului de HCI, apare foarte usor. Datorită modului preferat al acestei reacții, alte procese de clivare sunt observate numai la o temperatură ridicată în derivați perclorici. Acest - diclorurării (2) CI 2. conexiune inversă și scindarea legăturilor carbon-carbon, care poate avea loc sub acțiunea clorului - chlorolysis (3) sau hlorinoliz sau la temperatură ridicată - piroliză (4):
CH2CI-CH2CI2 = CHCI + HCI
CCI3-CCI3 CCI2 = CCI2 + CI2
CCI3-CCI3 + CI2 2CCI4
CCI3-CCI2-CCI3 CCI4 + CCI2 = CCI2
2. Termodinamica reactiilor de halogenare
Reacțiile de halogenare diferă foarte mult în ceea ce privește caracteristicile energetice, ceea ce determină caracteristicile lor esențiale. Mai jos vom compara efectele termice ale reacțiilor care implică fluor, clor, brom și iod pentru o stare gazoasă ideală a substanțelor:
După cum se poate observa din datele prezentate, efectul termic scade în seria F 2> CI 2> Br 2> I 2. Reacțiile de fluorurare și iodurare ocupă un loc special. Primele sunt însoțite de o eliberare foarte mare de căldură, depășind energia de rupere a legăturilor C-C și C-H. Dacă nu luați măsuri speciale, aceasta va duce la o descompunere profundă a materiei organice. Pe de altă parte, iodarea are un efect termic foarte mic sau chiar negativ și, spre deosebire de reacțiile cu fluor, clor și brom, este reversibilă. Aceasta, împreună cu o activitate scăzută a iodului ca reactiv, determină obținerea de derivați de iod prin alte căi. Cu toate acestea, ele sunt produse la scară mică și nu fac parte din produsele de sinteză organică și petrochimică de bază.
Efectele termice ale anumitor reacții care implică halogenuri de hidrogen cu o stare gazoasă ideală a substanțelor sunt următoarele:
C 2 H 4 + HF → C 2 H 5 F ()
C 2 H 4 + HCI → C 2 H 5 CI ()
C2H4 + HBr -> C2H5Br ()
C2H4 + HI → C2H5I ()
C 2 H 5 OH C 2 H 5 CI ()
Toate aceste reacții sunt exoterme, iar pentru halogenurile de hidrogen diferența este mai mică decât pentru halogeni liberi. Este important ca toate reacțiile care implică hidrogen halogenat să fie reversibile.
3. Agenți de halogenare
Cei mai importanți ca agenți de halogenare sunt halogeni liberi și halogenuri de hidrogen anhidru. Punctele lor de fierbere la presiunea atmosferică sunt date în tabelul 1.
Punctul de fierbere al halogenurilor și al halogenurilor de hidrogen la presiune atmosferică
Ele sunt solubile în lichide organice (Br2> CI2> F2 și HBr> HCI> HF), ceea ce este foarte important pentru procesele de halogenare în fază lichidă. Ele au un miros ascuțit, irită membranele mucoase ale ochilor și ale tractului respirator, iar halogeni liberi au, de asemenea, un efect sufocant. În special periculoase sunt fluorura și fluorura de hidrogen, care pot eroda pielea și țesutul osos.
Clorul se obține prin electroliza soluțiilor apoase de NaCI (saramură), când se formează simultan hidrogen și alcaline electrolitice:
Na + + HO-> NaOH
Gazul clor rezultat are o concentrație de ≈ 92% CI 2 și conține impurități N2O2 și CO. Ele pot fi separate prin clor de lichefiere, a cărui evaporare dă un produs pur, adesea mai preferabil pentru procesele de clorurare.
Clorura de hidrogen se obține prin sinteza la temperaturi ridicate din hidrogen și clor:
H 2 + CI 2 → 2 HCI
Fluorul este produs prin electroliza topiturii de hidrofluorură de potasiu KHF 2 și hidrogen fluorhidric anhidru - prin acțiunea acidului sulfuric pe fluorspar:
CaF2 + H2S04 → CaS04 + 2HF
Toți agenții halogenarea agresivi față de materialul echipamentului, iar efectul lor coroziv este crescută în special în prezența chiar urme de umiditate. Prin urmare, în procesele pentru fluorurarea echipamente de fabricare a cuprului folosit sau nichel, iar clorurarea și bromurare protejează oțelului emailurile corpului, plumb sau materiale ceramice, de asemenea, folosind tipuri speciale de oțel, grafit și biciuit pentru conducte - plumb. Pentru a reduce coroziunea, atât substanțele de halogenat cât și reactivii organici trebuie să fie uscați.
2. Siguranța proceselor de halogenare
În plus față de problemele generale legate de toxicitatea și explozivitatea materiilor prime (hidrocarburi, monoxid de carbon), o serie de condiții de siguranță specifice apar în timpul halogenării.
Nu numai agenții de halogenare, dar și derivații halogenați care rezultă au adesea o toxicitate crescută. Ele afectează sistemul nervos central, au un efect de umezire sau narcotice (cloroform, cloralhidrat), irita membranele mucoase ale ochilor și ale tractului respirator (benzil, cloracetonă) și fosgen are un efect sufocant. Ca urmare, cu halogenarea, există cerințe sporite pentru etanșeitatea echipamentelor și ventilarea magazinelor. Dispozitivele de prim ajutor și măștile de gaz sunt necesare la locul de muncă.
Halogenii liberi, cum ar fi oxigenul și aerul, pot da amestecuri explozive cu hidrocarburile și monoxidul de carbon. Procesul de ardere al acestora într-o atmosferă de halogeni este foarte exotermic și la anumite concentrații trece într-o explozie. Limitele explozive inferioare și superioare pentru amestecurile de parafine inferioare și olefine cu clor se situează în domeniul de la 5 până la 60% (v / v) hidrocarbură. Aceasta determină necesitatea unor măsuri de siguranță speciale atunci când se amestecă hidrocarburile cu halogeni, în special în cazul reacțiilor la gaze la temperaturi ridicate. Dar explozivitatea acestor industrii este sporită în continuare de faptul că mulți compuși halogenați dau amestecuri explozive cu aerul. Astfel, limitele explozive în amestecurile cu aerul sunt (v):
CH3CI - 7,6 ÷ 19,0
C 2 H 5 CI - 3,8 ÷ 15,4
C 2 H 4 CI 2 - 6,2 ÷ 16,0
Cu o creștere a numărului de atomi de halogen din moleculă, pericolul de explozie al compusului scade, iar tetraclorura de metan este chiar utilizată pentru a stinge incendiile.
3. Chimie și tehnologie de proces
Oxidarea și eliminarea HCI se efectuează în diferite reactoare. Dar dacă temperatura este ridicată la 400 - 4500С, este posibilă combinarea ambelor procese și compensarea excesivă a costurilor de încălzire pentru despicare. Aceasta este baza uneia dintre cele mai eficiente metode de obținere a tri- și tetracloretilenei din 1,2-dicloretan sau alți derivați de clor ai lui C2.
2CH2CI-CH2CI + CI2 + 1,5O2 -> 2CHCI = CCI2 + 3H20
2CH2CI-CH2CI + 2CI2 + 202-2CCI2 = CCI2 + 4H20
Comparativ cu o clorurare combinat și dehidroclorurare de 1,2-dicloretan se consum favorabil minim al clorului și absența formării de HCI subprodus. Evident, în acest proces, în funcție de raportul dintre clor și 1,2-dicloretan, un amestec de chloroethene și substanțe prohlorirovannye insuficiente reciclate în reacție. Procesul poate fi trimis la primirea trei comune - și tetracloroetilenă folosind ca materii prime nu numai 1,2-dicloretan, dar diferitele deșeuri clorurate C 2. Procedeul se realizează într-un catalizator în strat fluidizat, îndepărtarea excesului de căldură la fierbere condens apos și abur care generează ridicat presiune. În industrie, există instalații de mare putere pentru co-producție de trei - și tetracloroetilenă prin această metodă. Cu ajutorul tetracloretanului, nu este nevoie de clor străin:
CHCI2-CHCI2 + 0,5O2 - CCI2 = CCI2 + H20
Pentru a reduce și mai mult costul clorurate C 2 este utilizat ca materie primă sau un amestec de etan și etilenă. Astfel, procesul a fost de interes „Transkat“, în care reacția condusă în catalizatorul circulant oxiclorurare în topitură, cu separarea etapelor de clorinare și oxidare. Nu a fost dezvoltată din cauza sistemului greoi al circulației masei mari de topitură. Alte metode se bazează pe combinația sau combinația de clorurare directă și oxidativă cu eliminarea HCI și alte reacții. Astfel, într-unul dintre procesele implementate în industrie (Fig. 1), în reactorul 1 se combină clorurarea directă a etanului (sau amestecuri ale acesteia cu etilenă) și scindarea HCI clorurate. În sistemul 2 al primului produs etapă este chloroolefins izolat țintă (clorură de vinil vinildenhlorid) și celelalte substanțe, inclusiv etilena, etan neconvertit și HCI. este trimis în reactorul 3 pentru oxichlorurare. Acolo cloretan obținut, care este separat de aer și returnat în reactorul 1. Procesul este combinat cu hidroclorurare clorurii de viniliden pentru fabricarea de cloroform și oxidative clorurarea substanțelor organoclorurate nevizate în trei - și tetracloretilenă.
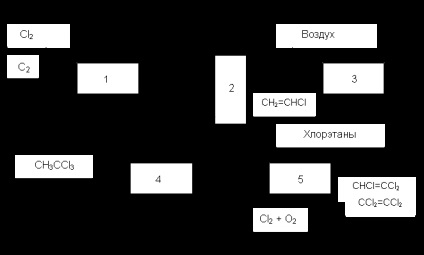

Fig. 1 Diagrama bloc a prelucrării combinate a etanului sau a amestecurilor acestuia cu etilenă
1. clorurare termică și dehidroclorurare, 2. Rectificarea, 3. oxidativa clorurare hidroclorurare 4., clorurare 5. oxidative și dehidroclorurare
Astfel, apariția proceselor industriale, combinate și combinate cu clivaj clorurate și clorinare oxidativ, are un efect profund asupra tehnologiei de fuziune produse organoclorurate majoritatea mnogotonazhnyh, eficiența economică a acestor plante și mediu. O dezvoltare și implementare intensă a acestor procese se desfășoară, care elimină treptat producția depășită și mai puțin eficientă.
2. Chichibabin începe chimia organică. M. Goskhimizdat, 1963. - 922 p .;
3. Lebedev și tehnologia de bază de sinteză organică și petrochimică. M. Chimie. 1988. - 592 p .;
4. Sinteza petrochimică Vishnyakova. M. 1973. - 448 p .;
5. Sinteza organică bazică Jukelson. M. "Chimie", 1968.