Problema 2. Desenați distribuția unui electron dens-
în moleculele următorilor compuși: a) 1-propanol; b) etil boran; c) 2-metilpropen; d) 1-butenă; e) 3,3,3-triclorpropen; e) izopropil litiu; g) 2-metoxi-1-butenă; h) 1-nitro-1-butenă.
În moleculele care nu conțin legături polare, densitatea electronului este distribuită uniform între atomi. Dacă în moleculă cel puțin o legătură este polară, dipolul acestei legături determină deplasări electronice în alte legături. Deplasările densității electronice pot fi cauzate de acțiunea fie a efectului inductiv al substituentului, fie, în cazul conjugării orbitalilor, cu efectul mezomeric.
Efectul inductiv este înlocuirea densității electronice a legăturii cauzată de legătura polară vecină. Acesta este notat cu litera I. Efectul inductiv al legăturii C-H este presupus arbitrar a fi zero. Dacă substituentul care induce deplasarea electronilor legați atrage electroni în sine mai puternic decât atomul de hidrogen, se atribuie un efect inductiv negativ (-I). Altfel, atunci când substituentul respinge densitatea electronică din sine mai puternic decât atomul de hidrogen, efectul inductiv este pozitiv (+ I).
Efectul mezomeric este capacitatea substituentului de a intra în interacțiunea orbitală cu legătura multiplă vecină. Substituții care asigură interacțiunea electronilor p sub forma unei perechi neparticipate (p, p-conjugare), adică contribuie la deplasarea densității electronice în direcția legăturii multiple vecine, prezintă efectul + M. Substituenții având o legătură multiplă polară intră în interacțiunea π, π (π, π-conjugare) cu o legătură multiplă separată de ea printr-o singură legătură simplă și schimbă densitatea electronică în sine. Au un efect M.
Polarizarea ambelor legături polare și polarizate ca urmare a efectelor de legături inductive și mezomerice este indicată de sarcini parțiale (δ- și δ +) la atomii corespunzători. În plus, săgețile de-a lungul legăturilor sunt folosite pentru legături simple și pentru mai multe legături - săgeți curbe de la conexiunea la atomul corespunzător (sau la o legătură simplă care separă legăturile multiple conjugate).
Problema 3. Comparați ratele de reacție ale electrofilului
în plus față de următorii compuși: etilenă, propenă, 3,3,3-trifluorpropenă, 2-metilpropenă.
Rata reacțiilor de adiție electrofilă la dubla legătură carbon-carbon sau reactivitatea în reacțiile lui Ad E. depinde de nucleofilitatea acestei legături. Nucleofilicitatea, adică abilitatea de a fi un donator al perechii de electroni, la rândul său, este proporțională cu valoarea densității electronice în această legătură. Prin urmare, pentru a compara vitezele, este necesar să se compare efectul substituenților (atomi și grupuri de atomi) asupra densității electronice a dublei legături, adică determină direcția și magnitudinea relativă a efectelor lor electronice.
CH2CH2CH3CHCH2CH2CHCFCH3CCH2
Într-o moleculă de etilenă cu atomi de carbon dintr-o dublă legătură, sunt asociate numai atomi de hidrogen, efectul inductiv fiind presupus a fi 0. Prin urmare, o moleculă de etilenă poate fi considerată standard,
într-un rând toate celelalte conexiuni.
În molecula propenică, gruparea metil prezintă + l-
efect, adică este un substituent care crește densitatea electronică pe o legătură dublă și, prin urmare, mărește reactivitatea propenului în reacțiile de adiție electrofilă în comparație cu reactivitatea etilenei.
Chiar mai reactiv decât etilenă și propenă este 2-metilpropenul. deoarece în molecula sa, dubla legătură are doi substituenți donatori de electroni.
In molecula de 3,3,3-trifluorpropenă trei atomi de fluor, din cauza mai mare electronegativitate lor în comparație cu atomul de carbon exponatul -I efecte care provoacă atomul de carbon la care sunt legați un deficit mare a densității de electroni. Acest lucru face ca gruparea trifluorometil să fie un agent puternic de îndepărtare a electronilor. Prin urmare, 3,3,3-trifluorpropenul este dezactivat în reacții de adiție electrofilă, adică verificate motivele
Reacționează cu reactivi electrofili mult mai lent decât etilenă.
Astfel, acești compuși pot fi aranjați într-o astfel de serie pentru a crește reactivitatea în reacții
3,3,3-trifluorpropen 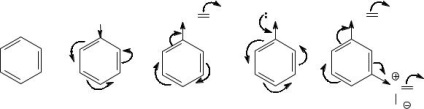
Problema 4. Comparați reactivitatea următoarelor
compuși în reacțiile de substituție electrofilă: benzen, toluen, benzaldehida, fenol, meta - nitrobenzaldehidă.
Reactivitatea compușilor aromatici în reacțiile de substituție electrofilă depinde de nucleofilitatea lor - capacitatea de a fi un donor de electroni, care depinde de densitatea electronică totală a nucleului aromatic. Substituenții, care au un efect de donare electronică asupra nucleului aromatic, cresc densitatea electronică pe acesta și astfel sporesc reactivitatea compușilor, i. E. activați-i la atac electrofil. Dispozitivele de îndepărtare a electronilor, reducând densitatea electronică a inelului aromatic, acționează ca substituenți de dezactivare. Prin urmare, pentru a compara reactivitatea, este necesar să se determine natura substituenților, pentru a descoperi toate efectele electronice prin care un anumit substituent afectează nucleul aromatic.
În moleculă de toluen, substituentul metil prezintă un efect de + I, adică este un donator de electroni. Prin urmare, toluenul în comparație cu benzenul este un compus activat și reacționează mai repede cu electrofilurile.
benzaldehida Molecule dezactivat la substituția electrofilă ca grupa formil este un substituent electrofilă (dezactivator) se manifesta cu privire la inelul benzenic și -I- și efectul -M.
Chiar mai dezactivat decât benzaldehida este metanitrobenzaldehida. pentru că, în plus față de grupul de electroni-formil în moleculă și încă prezintă un substituent puternic dezactivator, cum ar fi nitro (-I- și efectul -M).
Cel mai activ compus este fenolul. a cărui grupă hidroxil, în ciuda efectului -I, prezintă un puternic efect donor de electroni total asupra nucleului aromatic datorită conjugării p-π foarte eficiente (+ M >> -I).
Astfel, acești compuși sunt localizați în rândul următor în creșterea reactivității în reacțiile de substituție electrofilă:
meta -nitrobenzaldegid Problema 5. Comparați proprietățile acide ale următorilor compuși. (a) metan și nitrometan; b) etanol și 2-cloroetanol; c) metanol și metilamină; d) acid acetic și acetonă; e) Etanol și fenol. Justificați răspunsurile. Proprietățile acide conform teoriei Bronsted manifestată în capacitatea compușilor de a intra într-o interacțiune reversibilă cu un acceptor de protoni - bază - bază conjugată pentru a forma un acid de bază și conjugat se determină și poziția acestui echilibru. Cu cât balanța este deplasată mai mult spre dreapta, cu atât sunt mai pronunțate proprietățile acide. Comparați calitativ proprietățile acide ale diferiților acizi, comparând poziția echilibrului acid-bază al acestor acizi cu o anumită bază. Poziția de echilibru depinde de stabilitatea relativă a bazelor conjugate, prin urmare, pentru a compara proprietățile acide ale diferiților compuși, este necesar să se evalueze stabilitatea bazelor conjugate. Cu cât este mai stabilă baza conjugată, cu cât este mai slabă și, în consecință, cu atât este mai puternică Acid vuyuschaya. Stabilitatea baze conjugate care sunt acizi care nu au încărcături încărcate negativ particule - anioni afectează ambii factori intramoleculare și factori externi, cum ar fi, de exemplu, solvatare. Dacă solventul nu este specificat, având în vedere dependența stabilității bazelor conjugate numai de factori interni, care includ prima electronică: și anume, capacitatea atomilor adiacenți și grupurile de stabilizare a particulei încărcate negativ. Acest lucru poate fi un efect inductiv negativ al substituentului, care reduce sarcina negativa din cauza contracției densității de electroni, sau un efect negativ mezomeric indicativ al delocalizării densității de electroni și sarcina negativă. a) metan și nitrometan Am prezentat echilibrul acido-bazic pentru acești compuși cu o bază (B). În consecință, anionul nitrometanic este mai stabil decât anionul metil. Prin urmare, nitrometanul este un acid mai puternic decât metanul. Într-adevăr, nitrometanul ca acid este mai mare de 30 de ordine de mărime mai puternic decât metanul. b) etanol și 2-cloroetanol În moleculele de etanol și 2-cloretanol sunt atomi de hidrogen diferiți, dar proprietățile acide ale acestor compuși, datorită prezenței grupării hidroxil O-H ca acid, sunt mai puternice decât-H-acidul C (atomi de capacitatea transporta o sarcină negativă, în funcție de poziția lor în tabel periodic: în perioada în care crește de la stânga la dreapta). Prin urmare, echilibrul acido-bazic pentru acești compuși arată astfel:
CH3CH20H + BCH3CH20 + BH
CH2CH20H + BCH2CH20 + BH
2-Hloretoksid anion mai rezistent decât anion etoxidul ca un atom de clor, in curs de dezvoltare -I-efect, trage densitate de electroni de sigma legături, scăderea densității de electroni pe atomul de oxigen și slăbind bazicitatea. Prin urmare, 2-cloretanolul este un acid mai puternic decât etanolul.
c) metanol și metilamină
O-N-acizii, cum ar fi acizii N-H, sunt acizi mai puternici decât acizii C-H, astfel încât echilibrul acid-bază pentru metanol și metilamină arată astfel:
CH3NHH + BCH3NH + BH
Anionul metoxidic este o particulă mai stabilă decât anionul metilamidic, deoarece un atom de oxigen mai electronegativ "deține" o sarcină negativă mai ușor decât atomul de azot mai puțin electronegativ. Prin urmare, metoxidanionul este o bază conjugată mai slabă decât anionul metilamidic, iar metanolul este un acid mai puternic decât metilamină.
d) acid acetic și acetonă
Echilibrul acidului bazic pentru acid acetic și acetonă arată astfel: