O legătură chimică este o forță care reunește doi sau mai mulți atomi, ioni, molecule sau orice combinație a acestora. Prin natura sa, este o forță electrostatică de atracție între electronii încărcați negativ și nucleele încărcate pozitiv. Mărimea acestei forțe atractive depinde în principal de configurația electronică a carcasei exterioare a atomilor (vezi capitolul 1). De exemplu, gazele nobile formează greu legături chimice, deoarece au o carcasă electronică exterioară stabilă. Dimpotrivă, elementele ale căror atomi au doar un electron în cochilie exterioară formează ușor legături. Un exemplu de astfel de elemente este hidrogenul.
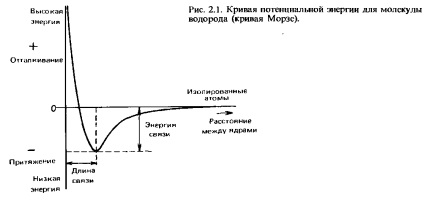
Când doi atomi de hidrogen se apropie de o distanță mică, aceștia sunt atrași unul de celălalt. Cu toate acestea, dacă sunt prea apropiați, repulsia are loc între ei. Optimal este distanța la care forțele de atracție și repulsie sunt echilibrate. La o asemenea distanță, energia potențială a celor doi atomi interacțioși este minimă. Această distanță este numită lungimea comunicației. Vom reveni la discuțiile mai detaliate din acest capitol. Ha Fig. 2.1 arată dependența energiei potențiale de distanța dintre nuclee. O curbă de acest tip se numește o curbă Morse. Energia necesară pentru a separa cei doi atomi interconectați și pentru a le îndepărta unul de celălalt la o distanță la care nu mai experimentează forța de atracție una față de cealaltă se numește energia de legare sau energia de disociere a legăturii. Determinarea sa experimentală se realizează prin măsurarea entalpiei legăturii (vom cunoaște acest concept în capitolul 5).
Abilitatea unui atom de a forma legături chimice se numește valența sa. Cu toate acestea, acest concept este considerat a fi învechit, deoarece acum este mult mai comună considerarea unei obligațiuni chimice în general, dar luând în considerare tipul său specific. Electronii, care participă la formarea legăturilor chimice, se numesc electroni de valență. Acești electroni se află la cele mai înalte orbitale energetice ale atomului (vezi capitolul 1). Carcasa exterioară a atomului, care conține aceste orbite, se numește coajă de valență.
Teoria electronică a valenței Concepțiile moderne ale naturii legăturii chimice se bazează pe teoria valenței electronice. Această teorie a fost dezvoltată independent de GN Lewis și V. Kossel în 1916. Conform teoriei valenței electronice, atomii care formează legături se apropie de realizarea celei mai stabile configurații electronice (adică cu cea mai mică energie). Atomii pot realiza acest lucru în două moduri:
1. Ei pot pierde sau dobândi electroni, formând ioni. Dacă atomii dobândesc electroni, devin anioni. Dacă pierd electroni, se transformă în cationi. Anionii și cationii cu o carcasă de electroni umplută exterioară au o configurație electronică stabilă. Între anion și cation există o legătură chimică, care este forța electrostatică a atracției. O legătură chimică de acest tip a fost denumită anterior o legătură electromagnetică; numele modern este legătura ionică.
2. Atomii pot, de asemenea, dobândi configurații electronice stabile, prin socializarea electronilor. Legătura chimică rezultată se numește o legătură covalentă. O legătura covalentă este formată ca urmare a socializării unei perechi de electroni furnizate una de la fiecare atom. Cu toate acestea, în unele molecule sau ioni poliatomici, ambii electroni pot fi furnizați numai de un atom. Acest tip de legătura covalentă se numește o coordonare, donator-acceptor sau legătura covalentă dativă.
Regula octet. Când un atom de orice element formează o legătură chimică, câștigă, pierderea sau socializare electroni de valență, configurația sa de electroni devine identică cu cea a atomului de gaz nobil situat la capătul aceleiași perioade ca element activ, sau la sfârșitul perioadei precedente. Atomii de gaz nobil cu excepția heliu, sunt în octetul rezistente înveliș exterior (opt) de electroni. Prin urmare, formarea de legături chimice prin realizarea unei configurații de electroni stabile ca în atomii gazelor nobile, este esența așa-numita regula octetului. Această regulă se aplică atât obligațiunilor ionice, cât și celor covalente.
Alte tipuri de legături chimice. Un caz special este legătura chimică în metale; nu poate fi atribuită fie tipului ionic, fie tipului covalent. În stare solidă, metalele constau din ioni încărcați pozitiv, încărcați dens într-o rețea de cristal și reținuți împreună de electroni liberi care "plutesc" în jurul ionilor din "marea electronică". Acest tip de conexiune se numește o legătură metalică.
Există încă două tipuri de legături chimice, care vor fi luate în considerare și în acest capitol. Aceasta este forța legată de hidrogen și van der Waals. Conexiunile acestor două tipuri sunt mult mai slabe decât cele de alte tipuri.