Aminoacizi: proprietăți fizice și chimice
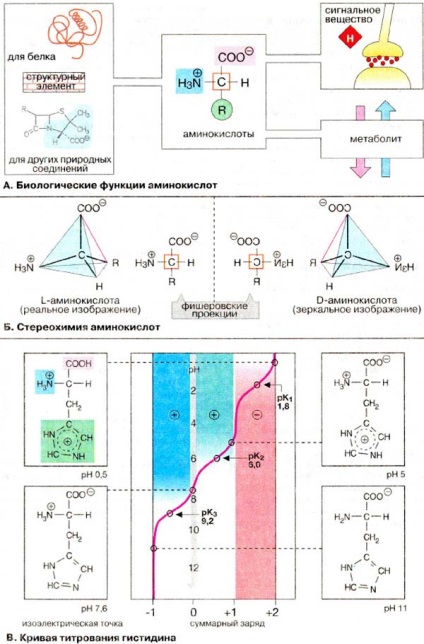
În organismele vii, aminoacizii îndeplinesc multe funcții.
1. Elemente structurale ale peptidelor și proteinelor. Proteina este alcătuită din 20 de aminoacizi proteinogenici (vezi pagina 67), care sunt codificați prin codul genetic și întăriți constant în proteine (vezi p. 244). Unele dintre ele sunt supuse unor modificări post-translaționale. și anume mogitul să fie focofilipovan, acilat sau hidroxilat (vezi pag. 122. 334).
2. Elemente structurale ale altor conexiuni naturale. Aminoacizii și derivații lor sunt incluși în coenzima coenzimelor (vezi pag. 110. 112), acizii biliari (vezi pagina 306), antibioticele (vezi p. 250).
3. Traductoare de semnal. Unii dintre aminoacizi sunt neurotransmițători (vezi pagina 342) sau precursori ai neurotransmițătorilor. mediatori sau hormoni (vezi pagina 368).
4. Metaboliti. Aminoacizii sunt cei mai importanți, iar unele dintre ele sunt componente vitale ale nutriției (vezi p. 348). Unii aminoacizi participă la metabolism. nappimep, donatori de azot clyzhat (vezi 191. 194 cc.) .Neproteinogennye aminokicloty obpazyyutcya ca produse promezhytochnyx la biocinteze aminoacizi și degradarea proteinogenici (vezi pp 399 - .. 402)., sau în ciclul ureei (vezi 184 c ..).
B. Stereochimia aminoacizilor
Aminoacizii naturali sunt acizi 2-aminocarboxilici (sau # 945; - aminoacizii, spre deosebire de Aminoacizi, cum ar fi # 946; -alanină și taypină). în # 945; -aminokiclot la C-2 (C # 945;) atom are patru diferite zamectitelya: grup kapbokcilnaya, o grupare amino, și lanț atom bokovaya vodopodny R. Astfel VCE # 945; - aminoacizii, în afară de glicină, au o asimetrie (chirală) Un atom de carbon și există ca doi enantiomeri (L- și D-aminoacid, vezi pagina 16). Proteinele aminociclonice sunt asociate cu seria L. D-aminoacizii se întâlnesc în bacili, de exemplu în mureine (vezi pagina 46) și în antibiotice peptidice.
În centrele chirale, este obișnuit să se descrie utilizarea formulelor proprietare. predpolozhennyh Fisher. Proiecția formyly vyvodyatcya de tpehmepnoy ctpyktypy cledyyuschim mod: tetraedru povorachivayut, astfel încât gpyppa mai okiclennaya (în clychae aminokiclot karbokcilnaya) a fost orientirovana în sus. Apoi, întoarceți-vă la acel nop, până când linia de conectare COO - și R (colorată în roșu) nu este înfundată în tabel. Acest polozhenii aminokiclot y L-NH3 + nanravlena grup va fi jucat la stânga, în timp ce acidul D-amino - la dreapta.
B. Curba de titrare a histidinului
B aminoacizii conțin cel puțin două grupe ionogene și, în consecință, sarcina sintactică depinde de pH-ul mediului. În grupările carboxil cu C # 945; pKa se află în intervalul 1,8-2,8, adică proprietățile acide ale acestor grupuri sunt mai pronunțate decât cele ale acizilor monocarboxilici nesubstituiți. pK # 945; - grupele amino sunt, de asemenea, diferite și se ridică la 8,8-10,6. Acidii și aminoacizii bazici poartă grupuri ionogene suplimentare în lanțul lateral (pKa din aceste grupuri sunt date la pagina 67). Încărcarea totală a peptidelor și a proteinelor depinde în principal de grupările ionice ale lanțurilor laterale, deoarece # 945; -COOH- și # 945; grupurile -NH2 participă la formarea legăturilor peptidice.
Dependența încărcării de aminoacizi asupra pH-ului mediului este clar vizibilă în exemplul de histidină. În histidină, împreună cu gruparea carboxil și amino la C # 945; (pKa 1,8 și, respectiv, 9,2), există un rest de imidazol cu pKa 6,0. Prin urmare, pe măsură ce pH-ul mediei crește, sarcina de histidină se schimbă de la +2 la -1. La pH 7,6, încărcarea totală este zero, în ciuda faptului că există două grupuri complet ionizate în molecula histidină. PH-ul la care încărcarea totală este zero se numește punctul izoelectric.
La punctul izoelectric, histidina este un ion de zwitter. adică molecula are proprietățile atât anionului cât și cationului. În regiunea neutră a pH-ului, majoritatea aminoacizilor sunt de asemenea ioni de zwitter.