Sorbție (din sorbeo-absorbția latină) - absorbția de către un corp solid sau lichid a diferitelor substanțe din mediul înconjurător. substanță Absorbit în mediu, numit sorbat (sorbtivom), corpul solid absorbant sau lichid - sorbent.
Prin natura absorbției fenomenelor sorbție sorbat sunt împărțite în două tipuri: de adsorbție - concentrația solutului la interfața sau stratul de suprafață de absorbție și absorbția sorbentului - absorbție volumetric în care solutului este distribuit în întregul volum al adsorbantului.
La rândul său, există două tipuri de adsorbție - physisorption la care creșterea concentrației de solut la interfața datorită nespecifica (adică nu depinde de natura substanței) prin forțe van der Waals și adsorbție chimică (chemisorpția) datorită reacțiilor chimice sorbat cu substanța suprafeței sorbentului. Absorbția fizică este slabă specifică, reversibilă și efectul său termic este mic (unități kJ / mol). Chemisorption selectiv, în general ireversibil și căldura este de la zeci la sute (chemisorpția oxigen pe metale) kJ / mol.
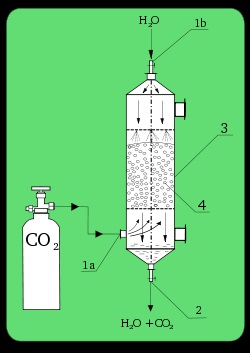
Absorbator de laborator. 1a). Introducerea CO2; 1b): intrare H2O; 2). de presă; 3). coloană de absorbție; 4). umplutură.
Absorbția în chimie este un fenomen sau proces fizic sau chimic. la care atomii. moleculele sau ionii intră în orice stare vrac - gaz. lichid sau solid. Acesta este un proces diferit de adsorbție. deoarece moleculele care sunt absorbite sunt preluate de volum, nu de suprafață (așa cum se întâmplă în cazul adsorbției). Un termen mai general este sorbția, care acoperă procesele de absorbție, adsorbție și schimb de ioni. Absorbția, în esență - este un proces în care ceva adaugă o altă substanță. [1]
Dacă absorbția este un proces fizic care nu este însoțit de alte procese fizice sau chimice, este de obicei supus legii distribuției Nernst:
"la echilibru, raportul dintre concentrațiile celui de-al treilea component în cele două stări lichide este o constantă.";
Volumul constantului KN depinde de temperatură și se numește coeficientul de distribuție. Această egalitate este adevărat, cu condiția ca concentrația nu este prea mare și în cazul în care moleculele sunt „x“ nu se schimbă forma în oricare alta dintre cele două state. Dacă o astfel de moleculă este supusă asocierii sau disocierii. atunci această ecuație în continuare descrie ca un echilibru între „x“ din ambele state, dar numai în aceeași formă - concentrarea tuturor formelor rămase trebuie să fie calculată luând în considerare toate celelalte echilibre. [1]
În cazul absorbției gazelor, concentrația poate fi calculată folosind, de exemplu, Legea gazului ideal. c = p / RT. În mod alternativ, presiunea parțială poate fi utilizată în locul concentrațiilor.
Multe procese importante punct de vedere tehnologic, absorbția chimică este utilizată în locul unui proces fizic, cum ar fi absorbția dioxidului de carbon cu hidroxid de sodiu - astfel de procese nu urmează distribuția legii Nernst.
Pentru câteva exemple de acest efect, se poate lua în considerare extracția. la care este posibilă extragerea componentei dintr-o fază lichidă a soluției și transferarea acesteia în cealaltă fără o reacție chimică. Exemple de astfel de soluții sunt gazele nobile și oxidul osmiic. [1]