Masa molară de acetonă
Acetona (dimetilcetonă) este o substanță complexă de natura organică a clasei de cetonă.
Structura moleculei este prezentată în Fig. 1. În condiții normale, acetona este un lichid volatil volatil mobil, cu un miros caracteristic. Densitate - 0,7899 g / cm 3. Se amestecă nelimitat cu apă și mulți solvenți organici (dietil eter, metanol, etanol, benzen etc.) și dizolvă bine și diverse substanțe organice.
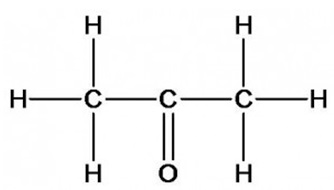
Fig. 1. Structura moleculei de acetonă.
Formula brută de acetonă este CH3-C (O) -CH3. După cum se știe, greutatea moleculară a moleculei este suma maselor relative atomice ale atomilor cuprinzând molecula (valorile masei atomice relative luate din Mendeleev Tabelul periodic sunt rotunjite la întregi).
Mr (CH3-C (0) -CH3) = 3x12 + 6x1 + 16 = 36 + 6 + 16 = 58.
Masa moleculară (M) este masa de 1 mol de substanță. Este ușor să se arate că valorile numerice ale masei moleculare M și ale masei moleculare relative sunt egale, dar prima cantitate are dimensiunea [M] = r / mol, iar a doua dimensiune este fără dimensiuni:
Aceasta înseamnă că masa molară de acetonă este de 58 g / mol.
Exemple de rezolvare a problemelor
Compuneți o formulă pentru combinația de calciu, carbon și oxigen dacă raportul masic al elementelor din el este m (C a): m (C): m (O) = 10: 3: 12.
Pentru a cunoaște în ce legătură se află elementele chimice din moleculă, este necesar să găsim cantitatea de materie. Se știe că pentru a găsi cantitatea unei substanțe, formula trebuie utilizată:
Să găsim masele moleculare de calciu, carbon și oxigen (valorile masei atomice relative luate din tabelul periodic al lui DI Mendeleev sunt rotunjite la întregi). Se știe că M = Mr, apoi (Ca) = 40 g / mol, M (C) = 12 g / mol și M (O) = 16 g / mol.
Apoi, valoarea materiei acestor elemente este egală cu:
n (Ca) = m (Ca) / M (Ca);
n (Ca) = 10/40 = 0,25 mol.
n (C) = 3/12 = 0,25 mol.
n (0) = 12/16 = 0,75 mol.
Să găsim raportul molar:
n (Ca): n (C): n (O) = 0,25: 0,25: 0,75 = 1: 1: 3.
și anume formula pentru combinația de calciu, carbon și oxigen este CaCO3. Acesta este carbonatul de calciu.
Formulați formula de oxid nitric, dacă fracțiunea de masă a azotului din acesta este de 30%, iar oxigenul - 70%.
Fracțiunea de masă a elementului X din molecula compoziției HX se calculează după următoarea formulă:
ω (X) = nx Ar (X) / M (HX) x 100%.
Să denotăm numărul de moli ai elementelor care compun compusul pentru "x" (azot) și "y" (oxigen). Apoi, raportul molar va arăta astfel (valorile masei atomice relative luate din tabelul periodic al lui DI Mendeleev sunt rotunjite la întregi):
x: y = ω (N) / Ar (N). ω (O) / Ar (O);
Aceasta înseamnă că formula pentru combinarea azotului cu oxigenul va avea forma NO2. Acesta este oxidul de azot (IV).