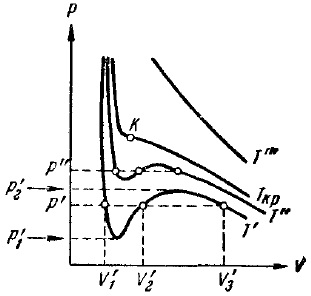
Figura 9. Izotermele Van der Waals
În Fig. Figura 9 prezintă izotermele Van der Waals pentru mai multe valori de temperatură. La o temperatură T 'și o presiune în intervalul p'1 p'2, coeficienții din (32) sunt astfel încât toate cele trei soluții ale ecuației se dovedesc a fi reale; la alte presiuni, o singură soluție va fi reală. Diferența dintre cele trei soluții reale ale ecuației cu scăderea temperaturii în creștere (comparați izotermele T 'și T ", T"> T "). Pornind de la o anumită temperatură Tcr pentru fiecare substanță, pentru orice presiune, o singură soluție de ecuație (32) rămâne reală. Temperatura Tcr este numită critică. Dacă temperatura este ridicată, atunci punctele corespunzătoare soluțiilor ecuației V'1. V'2 și V'3 converg tot mai mult, mergând la o temperatură critică într-una, indicată în Fig. 9 de K. Punctul K este numit critic. Pentru izoterma corespunzătoare, K servește drept punct de inflexiune. Există trei soluții reale consecutive ale ecuației (32). Tangenta la izotermei critică la punctul K este limita la care tinde p secante“, p„și m. G. Deoarece temperatura se apropie de valoarea critică. De aceea, această tangentă ca toate secants paralele cu axa V, derivata de la punctul K este În plus, al doilea derivat trebuie să fie egal cu zero în punctul de inflexiune.
Pentru a obține o izotermă experimental, este necesar să se ia problema în stare gazoasă, se pune într-un recipient cu un piston în mișcare (fig. 10) și încet începe să se comprime, făcând citiri simultane ale presiunii și volumului, precum și asigurarea că temperatura substanței a rămas constantă . Rezultatele unor astfel de experimente pentru o temperatură sub temperatura critică sunt date în Fig. 11. În primul rând, cu scăderea volumului de creșterea presiunii gazului, cursa izotermei este destul de bine descrisă de Van der Waals. Cu toate acestea, începând cu o anumită valoare a volumului V2. izotermul experimental încetează să mai urmeze ecuația (31). Pornind de la această valoare, volumul, presiunea din vasul încetează să se schimbe, substanța însăși, astfel, încetează să mai fie omogen: o parte a gazului condensează la un lichid. Există, așa cum se spune, stratificarea materiei în două faze: lichide și gazoase. Ca scădere în continuare mai mult substanței în faza lichidă, în care are loc tranziția la o presiune constantă, este indicat în Figura rn.p.
Figura 10. Schema de instalare pentru obținerea izotermelor experimentale
După procesul de condensare a substanței în capetele lichidului (acest lucru se produce când volumul Vj este atins), o scădere suplimentară a volumului începe să fie însoțită de o creștere rapidă a presiunii. Cursul izotermei se apropie din nou de ecuația (31). Substanța din stările corespunzătoare acestei secțiuni a izotermei va fi din nou omogenă, dar nu este un gaz, ci un lichid.
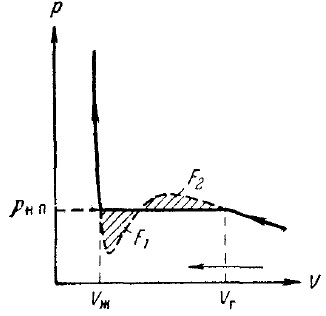
Figura 11. Izotermia gazului real
Astfel, ecuația van der Waals descrie nu numai starea gazoasă a materiei, ci acoperă și procesul de tranziție la starea lichidă și procesul de compresie a fluidului.
O comparație a izotermei izotermei experimental Van der Waals prevede că aceste izoterme coincid destul de bine în zonele care îndeplinesc starea singură fază a materiei, dar se comportă foarte diferit în separarea în două faze. In loc de forma literei S ondulare Izoterma Van der Waals izotermă experimentale în acest domeniu are porțiune rectilinie orizontală care este dispusă astfel încât zona acoperită de F1 și F2 ondulare (fig. 10) sunt identice.
În stările care corespund secțiunii orizontale a izotermei, se observă un echilibru între fazele lichide și cele gazoase ale substanței. Gazul (sau vaporii), în echilibru cu lichidul său, se numește abur saturat. Presiunea pnn la care echilibrul poate exista la o anumită temperatură se numește presiunea (sau elasticitatea) vaporilor saturați.
Raportul dintre masele lichidului și vaporii saturați în starea în două faze este egal cu raportul dintre segmentele în care punctul orizontal al izotermei împarte punctul reprezentând starea.
În Fig. 12 prezintă izotermele experimentale pentru mai multe valori de temperatură. Așa cum se poate observa din imagine, cu temperatură în creștere, secțiunea orizontală a izotermei contractează, contractând până la punctul la o temperatură critică Tcr. În concordanță cu aceasta, diferența dintre volumele specifice și, în consecință, densitățile lichidului și vaporii saturați scad. La o temperatură critică, această diferență dispare complet. În același timp, orice diferență dintre lichid și vapori dispare.
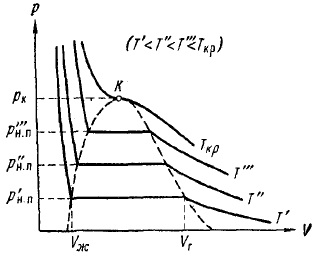
Figura 12. Izoterme experimentale pentru același gaz la temperaturi diferite
Din fig. 12 rezultă că presiunea saturată a vaporilor crește cu temperatura, atingând pcr la punctul critic. Dependența pH-ului. n pe temperatură este dată în Fig. 13. Curba se termină la punctul critic, deoarece la temperaturi peste punctul critic conceptul de vapori saturați își pierde semnificația. Curba începe de la așa numitul punct triplu Tp. Curba din Fig. 13 reprezintă locația geometrică a punctelor (valori de presiune și temperatură) în care fazele lichide și gazoase sunt în echilibru. Punctul triplu este un punct de echilibru al trei faze: solid, lichid și gazos.
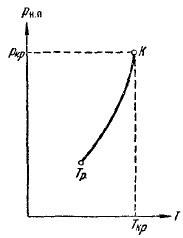
Fig. 13. Dependența presiunii saturate a vaporilor de temperatura
Dacă trasăm o linie prin punctele extreme ale secțiunilor orizontale ale izotermelor (Figura 12), se obține o curbă în formă de clopot, care limitează regiunea stărilor în două faze ale substanței. La temperaturi peste temperatura critică, substanța este omogenă la orice presiune. La astfel de temperaturi, nici o lichefiere a substanței nu poate fi realizată prin orice comprimare.
Conceptul de temperatura critică a fost introdus pentru prima dată în Mendeleev 1860, Mendeleev numita temperatura absolută a lichidului de fierbere și Ras privit ca temperatura la care forța de adeziune dispare între moleculele și lichidul se transformă în vapori, indiferent de presiunea și volumul pe care îl ocupă .
Curba în formă de clopot și secțiunea izotermei critice, situată la stânga punctului K, împarte diagrama (p, V) în trei regiuni (Figura 14). O ecloză oblică marchează aria stărilor lichide omogene de materie. Sub curba clopot este, după cum știm, zona de stat în două faze, și în cele din urmă, regiunea situată la dreapta curbei în formă de clopot și ramura superioară a izotermei critică, este o regiune de stare gazoasă omogenă a materiei. În cel de-al doilea, este posibil să se sublinieze partea care se află sub ramura dreaptă a izotermei critice, numind-o regiunea vaporilor. Orice stare din această regiune diferă de restul stărilor gazoase prin faptul că, sub compresie izotermică, o substanță inițial în această stare este supusă unui proces de lichefiere. O substanță într-una din stările deasupra temperaturii critice nu poate fi înrăutățită de nici o comprimare. Subdivizarea stărilor gazoase în gaze și vapori nu este în general acceptată.
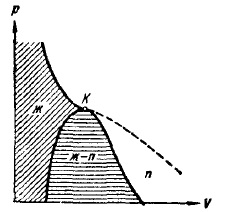
Fig. 14. Trei regiuni de state gazoase reale
Prin alegerea procesului de tranziție astfel încât să nu se intersecteze regiunea cu două faze, este posibil să se facă o tranziție de la starea lichidă la cea gazoasă (sau spate) fără delaminarea substanței în două faze. În acest caz, în timpul tranziției, substanța va rămâne omogenă tot timpul.
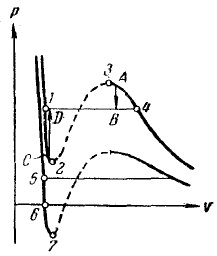
Fig. 15. Stări metastabile
Dintr-o comparație a izotermelor forțe Van der Waals cu izoterma experimental am constatat că, în loc de ondulare în formă de S -3 -4 1-2 (Fig. 15) Nye Izoterma experimental 1-4 are o porțiune rectilinie corespunzătoare materialului de stat în două faze. Acest lucru se explică prin instabilitatea stărilor omogene corespunzătoare curburii 1 -2 -3-4. Instabilitatea statelor din secțiunea 2 -3 devine evidentă dacă se ia în considerare faptul că derivatul din această secțiune este pozitiv. În consecință, o substanță capabilă să treacă o secvență de stări 2 -3 ar avea proprietăți complet nenaturale: o creștere a volumului gazului ar fi însoțită nu de o scădere, ci de o creștere a presiunii.
În secțiunile 1-2 și 3-4, este negativă, astfel încât s-ar părea că aceste zone ar putea fi realizate. Într-adevăr, în anumite condiții, statele care corespund acestor secțiuni pot fi realizate. Cu toate acestea, ele nu sunt destul de stabile: este suficient, de exemplu, capabil de a A lovit în perechi paiul toată materia a fost împărțit în două faze și a fost transferat la starea B (a se vedea o săgeată indică tranziția A -> B din figura 15 ..). Stări similare, care nu sunt complet stabile, sunt numite metastabile. O substanță în stările 1-2 se numește un lichid supraîncălzit, o substanță în stările 3 -4 se numește vapori suprasaturați.