Rezumatul a fost completat de un student de clasa a 11-a "Vasev Dmitri Alexandrovici
MOU secundar 2
Azot (informații generale).
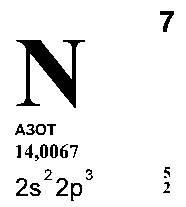
AZOT (Nitrogenium lat. - Gendereth nitrat), N (a se citi "en") - element chimic într-o a doua perioadă VA din tabelul periodic, numărul atomic de 7 masa atomica 14,0067. În forma sa liberă - gaz fără culoare, miros și gust, slab solubil în apă. Se compune din molecule de N2 diatomice cu rezistență ridicată. Se referă la metale nemetalice.
Compuși ai azotului
NITRATE - săruri ale acidului azotic HNO3, substanțe solide solubile în apă. Numele rus tradițional unele nitrați de săruri metalice și de amoniu alcaline și alcalino-pământoase - azotat de amoniu (nitrat de amoniu NH4NO3, azotat de potasiu KNO3, azotat de calciu Ca (NO3) 2 și altele.
NITRIDE sunt compuși chimici ai azotului cu mai multe elemente electropositive. Nitruri de aluminiu, bor, siliciu, wolfram, titan (AIN, BN, Si3N4, W2N, TiN) și multe altele - substanță cristalină refractare, rezistente chimic. Componente superaliaje sunt utilizate în dispozitive semiconductoare (de ex. Lasere semiconductoare, diode emițătoare de lumină) ca materiale abrazive. Acțiunea de azot sau amoniac la metale la 500-600 ° C, se obține acoperiri de nitruri (duritate ridicată, uzură și coroziune).
OXIZI DE AZOT: monoxidul de azot N2O și NO (gazele incolore) sescvioxid NO2 N2O3 (lichid albastru) Dioxid (gaz brun, în condiții normale, NO2 amestecului și dimerului său N2O4), oxid de N2O5 (cristale incolore). N2O și NO - oxizi nesoleobrazuyuschie, N2O3 cu apă dă acid azotos, N2O5 - azotic, NO2 - un amestec al acestora. Toți oxizii de azot sunt activi fiziologic. N2O - mijloace pentru anestezie ( „gaz ilariant»), NO și NO2 - intermediari în producerea de acid azotic, NO2 - agent de oxidare într-un lichid propulsor, amestecuri explozive, agent de nitrare.
Apare în purificarea apei, kerosenului și a anumitor uleiuri minerale; la fabricile de zahăr; la bronzarea pielii; În aerul clădirilor, unde sunt bovine; face parte din gazele cloaca (împreună cu hidrogenul sulfurat); este conținut în acetilenă nerafinată.
Folosit pentru producerea acidului azotic, azotat de amoniu și sulfat de amoniu, îngrășăminte lichide (ammiakatov), uree, carbonat de sodiu, în sinteza organică, în țesături vopsire schite de proiect (pe hârtie diazoniu) ca agent frigorific în frigidere, la oglinzi argintate.
Se obține prin sinteza directă din hidrogen gazos și azot la o presiune de obicei între 280-350 și 450-500 ° (în prezența catalizatorilor). În cantități mai mici se obține prin cărbune cocsificabil cu distilare cu "apă de amoniac" de var (prima fracțiune în distilarea uscată a cărbunelui).
Proprietăți fizice și chimice. Gaz incolor cu miros ascuțit ascuțit (prag de percepție 0,037 mg / l) și gust acru. T. topirea. -77,75 °; t. b. -33,35 °; carne. 0,771 g / l (0 °), 0,59 g / l (25 °). Sol. în apă aproximativ 750 g / l sau 526 g / l; Coef. sol. în apă 762,6. Solubil în eter și alți solvenți organici. Limitele concentrațiilor explozive în aer sunt 15-28%, în oxigen 13,5 - 79%, în oxidul de azot 2,2-72%. În aer, NH3 trece rapid în (NH4) 2CO3 sau este absorbit de umiditate. La temperaturi obișnuite este stabilă. Foarte reactiv, intră în reacțiile de adiție, substituție și oxidare. Soluția apoasă are o reacție alcalină datorită formării hidroxidului de amoniu NH * H. Produsul vine sub formă de soluții apoase conținând 28-29% (volum) NH3, soluție de NH3 10% (amoniac) sau NH3 lichefiat în cilindri din oțel.
Se utilizează în producția de coloranți organici; în industria alimentară; pentru pasivarea produselor din oțel; în industria cauciucului și a textilelor, în galvanizare.
Se obține prin absorbția unei soluții de sodă de gaze nitrose produse de acid azotic și prin purificare, evaporare și cristalizare a recipientului obținut de nitrit și azotat de sodiu.
Proprietăți fizice și chimice. Cristale incolore sau gălbui. T. topirea. 271 °; carne. 2.17: peste 320 ° dec. nu ajunge la fierbere; sol. în apă, 81,8 g / 100 g (20 °). 163 g / 100 g * O ").
Efect toxic. Cauzează vasodilarea datorată parezei vasului - centrul motorului (la doze mari și datorită acțiunii directe asupra vaselor de sânge), precum și formarea methemoglobinei în sânge.
Se folosește la producerea coloranților azo și a unor compuși organici.
Se obține prin reducerea plumbului KNO2 topit; prin trecerea de SO2 printr-un amestec încălzit de KNO3 și CaO.
Proprietăți fizice și chimice. Cristale incolore sau gălbui care se răspândesc în aer. T. topirea. 387 °; carne. 1,915; sol. în apă 280 g / 100 g (0 °); 413 g / 100 g (100 °).
Efectul toxic pare să fie similar cu cel al NaNO2.
(Azotat de sodiu, nitrat chilian)
Este folosit ca îngrășământ; în industria alimentară, sticlă, metalurgică; pentru producerea de explozivi, combustibil rachetă și amestecuri pirotehnice.
Se obține din depozite naturale prin leșiere cu apă fierbinte și cristalizare; absorbția prin soluția de sodiu a oxizilor de azot; schimbă descompunerea azotatului de calciu sau de amoniu cu sulfat, clorură sau carbonat de sodiu.
Proprietăți fizice și chimice. Cristale incolore. T. topirea. 309,5 °; carne. 2257; decembrie la 380 ° pe nitrit și oxigen; sol. în apă, 88 g / 100 g (20 °), 176 g / 100 g (100 °).
Este folosit ca îngrășământ, precum și în producția de praf de pușcă, în industria pirotehnică, în industria alimentară și a sticlei. Se obține prin conversia NaN03 și KCI la 80-122 ° C.
Proprietăți fizice și chimice. Cristale incolore. T. topirea. 334 °; carne. 2.11; decembrie mai mare de 338 ° pentru nitrit și oxigen; sol. în apă 31,5 g / 100 g (20 °), 245 g / 100 g (100 °).
(Azotat de calciu, sarepetru norvegian)
Este folosit ca îngrășământ.
Se obține pe baza gazelor azotate produse de acidul azotic.
Proprietăți fizice și chimice. T. Plavil. 561 °; decembrie la 500 °; pluta. 2,36; întinzând, în apă, 126 g / 100 g (20 °), 363 g / 100 g (100 °). Sarea anhidră și hidrații cristalini sunt foarte higroscopici.
Efect toxic. Tot ceea ce contează este iritant și efectul produsului brut, care este exprimat în înroșirea pielii, mâncărime, ulcerații, uneori profundă și ocupă o suprafață mare, care sunt lente pentru a se vindeca și se lasă mai multe cicatrici cauterizarea. Zonele afectate ale pielii, în cazul în care există cel puțin răni minore, zgârieturi și alte încălcări ale integrității sale teritoriale.
Densitatea azotului gazos la 0 ° C este de 1,25046 g / dm3, azotul lichid (la punctul de fierbere) este de 0,808 kg / dm3. Gazul de azot la presiune normală la o temperatură de -195,8 ° C trece într-un lichid incolor și la o temperatură de -210,0 ° C într-un solid alb. În stare solidă, există două modificări polimorfe: sub -237,54 ° C, o formă stabilă cu o latură cubică și mai mare cu o formă hexagonală.
Temperatura critică a azotului -146,95 ° C, 3,9MPa presiune critică, punctul triplu este la o temperatură de -210,0 ° C și o presiune de 125,03 hPa, ceea ce înseamnă că azotul la temperatura mediului ambiant pentru orice, chiar foarte mare presiune, nu poate fi transformat într-un lichid.
Căldura de evaporare a azotului lichid este de 199,3 kJ / kg (la punctul de fierbere), căldura de fuziune a azotului este de 25,5 kJ / kg (la o temperatură de -210 ° C).
Energia de legare a atomilor din molecula de N2 este foarte ridicată și ajunge la 941,6 kJ / mol. Distanța dintre centrele atomilor din moleculă este de 0,110 nm. Aceasta indică faptul că legătura dintre atomii de azot este triplă. Rezistența ridicată a moleculei de N2 poate fi explicată în termenii metodei orbitale moleculare. Schema energetică pentru umplerea orbitalilor moleculați în molecula de N2 arată că numai legăturile s și p orbitale sunt umplute cu electroni în ea. Molecula de azot este nonmagnetică (diamagnetică).
Datorită înaltă rezistență N2protsessy molecule descompunerea diferiților compuși cu azot (inclusiv notoriu exploziv RDX) atunci când sunt încălzite, lovituri, etc .. G. duce la formarea de molecule N2. Deoarece volumul gazului format este mult mai mare decât volumul explozivului inițial, o explozie zgomotă.
Din punct de vedere chimic, azotul este destul de inert și reacționează numai cu metalul de litiu la temperatura camerei pentru a forma nitrilul litiu solid Li3N (3Li + N = Li3N-3).
În compuși, acesta prezintă diferite grade de oxidare (de la -3 la +5). Cu hidrogen formează amoniac NH3. (3H + N = NH3) Indirect (nu de la substanțe simple), se obțin hidrazina N2H4 și acidul azotic HN3. Sărurile acestui acid sunt azide. Azidul de plumb Pb (N3) 2 se descompune la impact, prin urmare este folosit ca detonator, de exemplu, în capsule de cartuș.
Sunt cunoscuți mai mulți oxizi de azot. Cu halogeni azot nu reacționează în mod direct căi indirecte obținute NF3, NCl3, NBr3 și NI3, precum și mai multe oxihalogenuri (compuși din compoziție care, în afară de atomii de azot, și include halogen și oxigen, de exemplu, NOF3).
Halogenurile de azot sunt instabile și se descompun imediat după încălzire (unele în timpul depozitării) în substanțe simple. Astfel, NI3 precipită atunci când soluțiile apoase de amoniac și tinctură de iod sunt drenate. Chiar și cu un ușor tremur, NI3 uscat explodează:
Azotul nu reacționează cu sulful, carbonul, fosforul, siliciul și alte nemetale.
Când este încălzit, azotul reacționează cu magneziu și alcalino-pamantoase, in care nitrurilor saltlike având formula generală M3N2 (3M + N2 = M3N2), care sunt descompuse de apă pentru a forma hidroxidul corespunzător și amoniacul, de exemplu:
Ca3N2 + 6H2O = 3Ca (OH) 2 + 2N + 3H3.
Alchilii metalici alcalini se comportă într-un mod similar. Interacțiunea dintre azot și metalele de tranziție conduce la formarea de nitruri metalice solide de diferite compoziții. De exemplu, în interacțiunea fierului și azotului se formează nitruri de fier cu compoziția Fe2N și Fe4N (N2 + 6Fe = Fe2N + Fe4N). Când hidrogenul este încălzit cu acetilenă C2H2, poate fi obținut acid cianhidric HCN (N2 + C2H2 = 2HCN).
Dintre compușii complexi de azot anorganici, cele mai importante sunt acidul nitric HNO3, sărurile sale azotate, precum și acidul azotic HNO2 și sărurile sale de nitriți.
În industrie, azotul este obținut din aer. Pentru acest prim răcit cu aer este lichefiat și aerul lichid este supus distilării (distilare). Punctul de fierbere al azotului este puțin mai mic (-195,8 ° C), altele decât componentele de aer - oxigen (-182,9 ° C), prin urmare, primul azot evaporată cu aer lichid încălzire blândă. Consumatorii de gaz de azot este furnizat într-o formă comprimată (150 atm., sau 15 MPa) în cilindri de negru având o inscripție „azot“ galben. Depozitați azot lichid în vasele Dewar.
În laborator se obține azot pur ("chimic") prin adăugarea unei soluții saturate de clorură de amoniu NH4CI la azotatul de sodiu solid NaNO2 prin încălzire:
NaNO2 + NH4CI = NaCI + N2 + 2H2O.
De asemenea, puteți încălzi azotatul de amoniu solid:
NH4NO2 = N2 + 2H20.
În industrie, gazul de azot este utilizat în principal pentru a produce amoniac. Ca gaz inert chimic, azotul este utilizat pentru a furniza un mediu inert în diferite procese chimice și metalurgice, în timp ce transferă lichide inflamabile. Azotul lichid este utilizat pe scară largă ca agent de răcire, este utilizat în medicină, în special în cosmetologie. Îngrășămintele cu azot au o importanță deosebită pentru menținerea fertilității solului.
Descoperit în 1772 de către omul de știință scoțian D. Rutherford constând din produse de combustie a cărbunelui de sulf și fosfor ca gaz, improprii pentru respirație și de ardere ( „sufocare aer“) și, spre deosebire de soluție alcalină absorbabil CO2ne. La scurt timp după chimistul francez AL Lavoisier a ajuns la concluzia că „sufocantă“ gazul intră în aer, și a sugerat să-i numele de „azotul“ (din azoos greacă -. Tern). In 1784 fizicianul englez și chimist H. Cavendish a stabilit prezența azotului în nitrat (de unde și numele latin pentru azot, propus în 1790 de către chimistul francez Chantal J.).
Referințe
"Efectul otrăvitor al compușilor de azot asupra corpului uman" (Un document din cache www.google.ru).
"Primirea și aplicarea azotului și a compușilor săi" (Un document din cache www.google.ru).