Clasificarea amestecurilor cu două componente. Dacă din cauza căldurii mișcării Vågå a moleculelor din lichid în spațiul de vapori, în unitatea de timp trece același număr de molecule mutat înapoi din vaporii în lichid dintre amestecul lichid, conținut într-un vas închis, și se stabilește vaporii deasupra fazei mobile. " echilibru.
Mișcarea termică a moleculelor cauzează expansiunea gazului, care este detectată ca "presiune termică". Cu cât este mai mare, cu atât este mai mare temperatura și cu atât sunt mai multe molecule pe unitate de volum. Pentru gazele ideale, presiunea termică este direct proporțională. temperatura absolută și invers proporțională cu volumul specific. Presiunea termică a unui lichid, despre care se știe că are un volum specific mai mic decât un gaz, atinge câteva mii de atmosfere la o anumită temperatură, adică mult mai mult decât un gaz. În gazele ideale, în ambele perechi, presiunea termică este echilibrată de presiunea externă; în lichide, este în mare măsură compensată de o presiune direcționată în direcția opusă față de presiunea de oscilare, determinată de forțele interne de atracție a moleculelor. Excesul de presiune termică deasupra coeziunii este presiunea de vapori.
Presiunile parțiale ale unui amestec gazos sau lichid ar trebui de asemenea considerate drept presiunea termică a componentelor individuale, reduse prin cantitatea forțelor coezive. În amestecuri de gaze și vapori ideale neglijabile, în care forțele de coeziune, permițând parțială Leniye fiecare componentă este egală cu presiunea termică, și, în consecință, dar, la o temperatură dată este proporțională cu numărul de molecule, respectiv stvuyuschego-component pe unitatea de volum.
Deoarece presiunile parțiale ale componentelor într-un amestec de lichide sunt determinate în principal de forțe coezive, este în primul rând necesar să se ia în considerare interacțiunea dintre moleculele individuale.
Fie forța cu care două molecule adiacente dintr-o componentă sunt atrase în lichid să fie o forță de atracție reciprocă a celor două molecule ale celei de-a doua componente a a22 și, în final, forța de atracție a moleculelor celor două componente inegale.
Dacă forțele au, a22 și a12 sunt egale unul cu celălalt, lichidele sunt solubile reciproc unul în altul în orice raport și amestecurile lor se numesc daisy. n s. m și. r a ct er erm.
Forța totală cu care orice moleculă este reținută în amestec nu depinde de compoziția amestecului în acest caz, deoarece este imaterială dacă molecula este înconjurată de un număr mare de molecule ale primei sau celei de-a doua componente. Presiunea parțială a componentei depinde numai de numărul moleculelor sale care ajung la suprafața lichidului într-un moment cu viteza minimă necesară pentru a depăși forțele coezive. La o anumită temperatură, presiunea componentei corespunzătoare crește proporțional cu conținutul său în lichid.
În soluții ideale, echilibrul dintre lichid și vapori se stabilește în conformitate cu legea lui Raoult.
Dacă forța de atracție a moleculelor a două componente inegale a este mai mică decât forțele a1x și a22, atunci moleculele sunt reținute în soluție mai slabă decât atunci când sunt înconjurate de molecule de o singură componentă. Prin urmare, moleculele sunt mai ușor de trecut în spațiul de vapori, iar presiunea parțială într-o astfel de soluție este mai mare decât în soluția ideală (amestecuri cu o abatere pozitivă față de legea lui Raoult).
Există, de asemenea, amestecuri în care forța a12 este mult mai mare decât forțele a și a22. Apoi, moleculele sunt reținute mai puternic în componentele pure și, prin urmare, presiunile parțiale sunt mai mici decât în soluțiile ideale (amestecurile cu o abatere negativă față de legea lui Raoult).
Dacă forța a12 este foarte mică în comparație cu a1X și a22, atunci aceleași molecule tind să se unească și diferitele molecule sunt separate una de cealaltă. În acest caz, amestecurile sunt stratificate și, în consecință, constau din lichide insolubile reciproc.
Pe lângă soluțiile ideale și amestecurile de lichide insolubile reciproc, există amestecuri de lichide care au o solubilitate parțială între ele.
Astfel, toate amestecurile lichide bicomponente, în funcție de gradul de solubilitate reciprocă a componentelor lor, pot fi împărțite în trei grupe:
fluide care sunt solubile reciproc în orice relație;
lichide parțial solubile unele în altele;
lichid, reciproc insolubil.
Lichide care sunt reciproc solubile în orice relație. Când amestecul lichid este format din două componente, complet solubile unul în celălalt, elasticitatea fiecărui vapori de componente este redus, iar amestecul total de vapori de presiune, punctul de fierbere și concentrația de vapori nu este constantă, variind în funcție de modificările în amestecul lichid de co-stava.
Lichidele care sunt solubile reciproc în orice relație sunt împărțite în trei grupe:
1. Amestecuri de lichide solubile în orice privință, care nu au o temperatură constantă la fierbere. Vaporii degajați prin evaporarea unor astfel de lichide diferă în compoziție de compoziția amestecului lichid, cu componenta ușor volatilă în vapori deasupra lichidului întotdeauna mai mare decât în lichid. Punctul de fierbere al acestor amestecuri, în funcție de compoziția lor, variază de la punctul de fierbere al unei componente pure la punctul de fierbere al celeilalte componente.
Un amestec de două lichide care sunt solubile în orice relație este un sistem alcătuit din două faze și două componente și, prin urmare, conform regulii de fază, este un sistem care are două grade de libertate.
Cu toate acestea, din punct de vedere practic, o variabilă este considerată constantă și o diagramă de fază este construită într-un sistem plan de coordonate. Următoarele diagrame de faze pot fi obținute: presiunea-temperatură (constanta compoziției), compoziția de presiune (constantă de temperatură), compoziția temperaturii (constanta de presiune).
De exemplu, să luăm în considerare diagramele de fază pentru un amestec bicolor de benzen-toluen.
Acest amestec este ideal și prin urmare presiunile parțiale ale componentelor conform legii lui Raoult (la temperatură constantă) sunt: componentul volatil A (benzen)
Componenta volatilă B (toluen)
Unde Pg este presiunea de vapori a componentei pure A; Rv-elasticitatea unei vapori a componentei pure B; Xa este fracția moleculară a componentei A din lichid; 1 este fracția moleculară x a componentei B din lichid.
Cunoscând valorile pA și pBj, găsim presiunea totală a vaporilor P a amestecului ca sumă a presiunilor parțiale ale componentelor
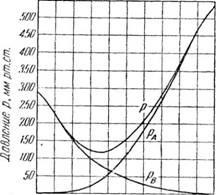
Din cele trei ecuații se observă că, la o temperatură constantă, presiunile parțiale ale componentelor, precum și presiunea totală a vaporilor amestecului, sunt lineare în fracția moleculară xA a componentei volatile ușoare din lichid. În Fig. 376, aceste dependențe sunt reprezentate grafic, cu linii drepte OB și DA reprezentând schimbarea presiunilor parțiale ale componentelor și variația directă AB a presiunii totale.
Pentru a determina temperatura amestecului de fierbere al compoziției dată, construită prin intervalul metodei de mai sus izotermele AB, A'b“, A«B»exprimă-ing presiunea totală a vaporilor la diferite temperaturi (/, ∞, i„). Liniile presiunilor parțiale pA și pB se obțin prin îmbinarea punctelor A, A ', A "cu punctul D și cu punctele B, B', B" cu punctul O.
Mai mult, linia orizontală MN este trasă în funcție de presiunea externă. Restaurarea dintr-un punct corespunzător dat co-stavuhA * linia verticală la intersecția cu linia MN, sunt punctul R pe T. izotermei La această temperatură T la presiunea vaporilor totală a amestecului este egală cu presiunea externă și de temperatura T este temperatura de fierbere a amestecului sostavahA-
Dacă astfel determina amestecuri de fierbere timp compoziție Nogo (la aceeași presiune) este reprezentată grafic de-a lungul compozițiile abscisă și pe corespunzătoare temperaturii de fierbere axa ordonatei razei pe curba de fierbere prezentat în Fig. 376, II, pentru amestecul de sol-ben toluen. Curba superioară din figură prezintă compoziția de echilibru a vaporilor la punctul de fierbere al amestecului.
Cu compoziția unui amestec de xx părți dintr-un mol de benzen ușor și temperatura tx, există practic numai o singură fază lichidă, un amestec de benzen și toluen. Pe măsură ce temperatura amestecului se ridică la t2, apare o fază de vapori a compoziției x2. Deoarece presiunea este constantă, în prezența a două faze, va exista doar un grad de libertate și, prin urmare, cu schimbarea temperaturii, se va schimba și compoziția fazelor.
Cu o creștere suplimentară a temperaturii, cantitatea de fază lichidă va scădea și aburul va crește și la o temperatură în care compoziția de vapori este egală cu compoziția amestecului inițial,
În aceeași diagramă se poate descrie procesul de condensare succesivă pornind de la faza de vapori a compușilor 2 și printr-o serie de procedee succesive de condensare și evaporare se obține un lichid constând dintr-o componentă pură, ne-volatilă.
Poziția reciprocă a curbelor în diagramele de fază este determinată de prima lege a lui DP Konovalov: vaporii sunt îmbogățiți cu acea componentă, adiția la care lichidul ridică presiunea de vapori deasupra sau scade punctul său de fierbere. Această lege se aplică tuturor amestecurilor lichide. Adăugarea benzenului la amestecul benzen-toluen scade punctul său de fierbere și, prin urmare, concentrația benzenului în vapori va fi mai mare decât în lichid. Din fig. 376 că aceasta corespunde dispunerii curbelor, în care curba compoziției vaporilor este întotdeauna mai mare decât curba compoziției lichidului.
Diagonala corespunde unui conținut egal al componentei volatile în vapori și lichide = y.
Curba de echilibru pentru soluții care respectă legea lui Raoult poate fi construită (vezi p. 457) prin ecuație
VA = _____________ (3-165)
În cazul în care a este volatilitatea relativă. Cu cât este mai mare valoarea numerică a,
Cu cât abia deviază curba de pe diagonală, cu atât este mai mare diferența în compoziția vaporilor și a lichidului și cu atât este mai ușor să împărțiți amestecul în componente. Pe diagrama y-x, punctele de fază ale vaporilor și lichidului se îmbină într-un singur punct, întotdeauna situându-se pe curba de echilibru.
Curba de echilibru și diagonala limitează regiunea de existență reciprocă a celor două faze. Deasupra curbei de echilibru este regiunea de vapori, iar mai jos este regiunea lichidă.
Exemple tipice de astfel de amestecuri sunt soluțiile apoase de acizi minerali, de exemplu soluții apoase de acizi azotați și clorhidric.
Diagramele de faze pentru amestecul acid azotic-apă sunt prezentate în Fig. 377.
Apa curată se fierbe la 100 °, acidul azotic pur la 86 °, se dizolvă HN03 în apă cu un conținut de HN03 de 68,5% în greutate. se fierbe la o temperatură constantă de 121,9 °.
Pe diagrama t-x (figurile 377, II), curba dependenței punctului de fierbere al unui astfel de amestec de compoziția sa are un maxim de punct de fierbere (punctul M). Conform legii Konovalov, curba superioară corespunde compoziției vaporilor, curba inferioară corespunde compoziției lichidului la diferite temperaturi de fierbere și presiune constantă.
În Fig. 377, III prezintă diagrama y pentru amestecul acid azotic-apă. Punctul M, în care curba intersectează diagonala, corespunde
0 10 20 30 40 50 60 70 80 00 100
/ O 20 30 40 50 60 70 80SO77777 Conținut / іє lollol / е / пу / его / nitric și și ело P7ь /),% тІІ
Fig. 377. Diagramele p-x (1), І-х (11) и-Х (111) pentru amestecul cu punctul de fierbere maxim (azot-apă-acid).
String aceeași compoziție de lichid și de abur; se numește un punct caracteristic. Prezența unui astfel de punct indică faptul că amestecul nu poate fi împărțit în componentele sale pure.
3. Amestecuri de lichid-stey mutual rase - SO solubile in oricare din uzură, având compoziția într-un anumit punct de fierbere constant sub temperatura de fierbere a componentelor pure care constituie amestecul (CME-B având o temperatură minimă de fierbere). În distilarea lichidelor cu o compoziție constantă de fierbere a vaporilor va fi identic cu compoziția lichidă și: astfel, ele sunt de asemenea imposibil să se separe în componentele pure.
Exemple tipice de astfel de amestecuri sunt amestecurile de alcool etilic cu apă și alcool etilic cu benzen.
Cu aceeași compoziție de lichid și de vapori.
Amestecuri având o temperatură maximă sau minimă ki cântând, nerazdelnokipyaschuyu distilativă pot fi împărțite în amestec în stripare x0 compoziția și excesul (în comparație cu compoziția inseparabil - amestec de fierbere), componente în reziduu; pentru a obține ambele componente în formă pură prin distilarea unor astfel de amestecuri este imposibilă.
De exemplu, luați în considerare diagrama de fază din Fig. 377, II. Lichidul din compoziția inițială x> x0 se fierbe la o temperatură tx și dă o vapori de compoziție y, îmbogățită într-o componentă mai volatilă. În procesul de distilare, lichidul va fi îmbogățit cu o componentă mai puțin volatilă, iar punctul x se va deplasa spre stânga. Ca urmare, este posibil să se obțină în reziduu o componentă pură mai puțin săracă în distilat și un amestec care nu fierbe de xo, dar separarea ulterioară a amestecului este imposibilă, deoarece se fierbe fără a se schimba compoziția
Dacă amestecul inițial are compoziția x '<Сх0, то она закипает при температуре tx и дает пар состава у', обогащенный менее летучим компо-нентом. В процессе перегонки точка х' перемещается вправо, и перегонка приводит к разделению смеси на менее летучий компонент в дистилляте и нераздельнокипящую смесь в остатке.
Lichid parțial solubil unul în celălalt. Studii CME-aceasta este parțial solubil în fiecare alte lichide au fost mai întâi CHECK Dena Abashevo Alekseevym și [4]. Alekseev a demonstrat posibilitatea de a construi depozite caracteristice parabolice ale curbelor de solubilitate. Fiecare dintre curbe este format din două ramuri, convergente împreună la o temperatură la „solubilitate maximă. Până în acest punct al celor două lichide atunci când sunt amestecate da un interval de concentrație cunoscută de reprezentare cu două straturi, se ridică la cele două soluții de compoziție diferită (soluție lichidă A) de lichid B și soluția lichidul din lichidul a). Ca punct general, ambele soluții au aceeași compoziție.
Temperatura care corespunde acestui punct maxim se numește temperatura critică de dizolvare. La o temperatură mai ridicată, ambele lichide se amestecă, adică se dizolvă reciproc în orice relație.
Un exemplu clasic de lichide parțial solubile este fenolul și apa. La 20 ° apă se dizolvă 8,4% fenol, iar la 50 ° solubilitatea fenolului în apă crește la 12,08%. Fenolul la rândul său dizolvă apa la 20 ° în cantitate de 27,76% și la 50 ° -37,17%.
Dacă solubilitatea reciprocă a fenol și apă pentru a descrie dia gram (Fig. 379), se pare că curbele de solubilitate reprezentate în prezent una curbă care trece printr-un maxim la un punct corespunzător conductiv compoziție 35,99% fenol la £ = 68,8 °.
Când există doar o singură fază lichidă și o fază de vapori în sistem, atunci tot ceea ce sa spus despre lichide se aplică complet.
au creat unul în celălalt. Atunci când cele două faze lichide și un abur Leniye preveni amestecul de vapori rămâne constantă atâta timp cât există două straturi, adică. E., Un astfel de sistem este un fel de amestec de lichide reciproc insolubile.
Există, de asemenea, cazuri de solubilitate limitată a celor două lichide, când solubilitatea reciprocă completă nu se produce odată cu creșterea, dar cu scăderea temperaturii. Un exemplu este un amestec de apă și trietilamină, pentru care există o temperatură critică de dizolvare minimă de 20 °.
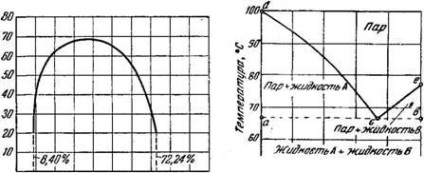
Fig. 380. Diagrama T-x pentru lichide nemiscibile.
Unele amestecuri de două lichide (de exemplu, nicotină și apă) au temperatura maximă și minimă de dizolvare critică și, prin urmare, curba lor de solubilitate reciprocă reprezintă o linie închisă.
Lichide care sunt reciproc insolubile. Atunci când se amestecă două lichide reciproc insolubile, fiecare își păstrează complet proprietățile. Un astfel de amestec poate fi împărțit cu ușurință în părți componente prin mijloace mecanice, prin sedimentare. Sistemul este alcătuit din două componente și trei faze și, prin urmare, are un grad de libertate. Aceasta indică faptul că la fiecare temperatură particulară a amestecului va exista o presiune bine definită și fiecare componentă se va comporta ca și cum ar fi singură în forma sa pură.
Cu alte cuvinte, în amestecul constând din lichide insolubile reciproc, presiunea parțială a fiecărui component nu depinde de conținutul său în amestec și este egală cu presiunea de vapori a componentei pure la aceeași temperatură.
Abordarea orizontală din diagramă limitează regiunea existenței unui amestec de lichide A și B, iar punctul c corespunde punctului de fierbere al amestecului, punctul de fierbere al amestecului fiind situat sub punctul de fierbere al componentelor individuale. Această proprietate este utilizată în tehnologie pentru
distilarea lichidelor cu punct de fierbere ridicat cu abur. Raportul dintre cantitățile de greutate ale componentelor din vapori se găsește în formula
Lichide absolut insolubile nu există în natură; gradul de solubilitate a acestora depinde în mare măsură de temperatură. În unele cazuri, solubilitatea nesemnificativă este neglijată, presupunând că lichidele sunt practic insolubile reciproc, ceea ce face posibilă utilizarea formulării reduse (3-166).
Cea mai simplă schemă a unității de extracție pentru acțiunea periodică de extracție a solidelor este prezentată în Fig. 401. Amestecul ce urmează a fi extras este încărcat în extractorul 1 în care se toarnă simultan o anumită cantitate de solvent pur. Prin "...
Difuzia moleculară. Când fazele sunt în echilibru, compoziția lor rămâne constantă. Procesele de difuzie apar doar atunci când echilibrul de fază este perturbat, în timp ce componentele distribuite între faze merg de la o fază la alta. În ...