De ce să obțineți hidroxid amfoteric din soluția de sare a elementului de tranziție, soluția alcalină este turnată în picături?
Când se adaugă prin picurare la soluția de soluție de hidroxid de sodiu clorură de zinc, are loc mai întâi formarea hidroxidului de zinc insolubil și a clorurii de sodiu.
1. ZnCl2 + 2NaOH = Zn (OH) 2 + 2NaCl
Dacă, după ce toată clorura de zinc reacționează să continue turnarea hidroxidului de sodiu, acesta începe să reacționeze cu hidroxidul de zinc care tocmai sa format. Se formează zinc de sodiu și apă.
2. Zn (OH) 2 + 2 NaOH = Na2Zn02 + 2H20.
Prin urmare, pentru prepararea hidroxidului de zinc, trebuie adăugată prin picurare o soluție alcalină pentru a forma un precipitat insolubil de Zn (OH) 2 (reacția nr. 1), dar prevenirea reacției nr.
Dați două ecuații moleculare de reacții corespunzătoare ecuațiilor ionice reduse:
a) Be (OH) 2 + 2H + → Be2 + + 2H20;
b) Be (OH) 2 + 2OH - → Be02 2 + 2H2O
a) Be (OH) 2 + 2H + → Be2 + + 2H20;
1. Be (OH) 2 + 2HCI = BeCI2 + 2H20;
2. Be (OH) 2 + 2HNO3 = Be (N03) 2 + 2H20;
b) Be (OH) 2 + 2OH -> Be02 2- + 2H2O;
1. Be (OH) 2 + 2NaOH = Na2Bu02 + 2H20;
2. Be (OH) 2 + 2KOH = K2Bu02 + 2H20;
Notați ecuațiile de reacție pentru următoarele transformări:
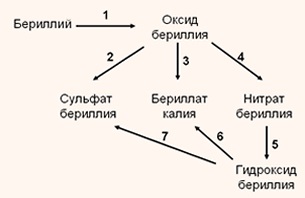
1. 2Be + 02 = 2BeO
2. BeO + H2S04 = BeS04 + 2H20;
3. BeO + 2KOHizb. = K2Be02 + H20;
4. BeO + 2HNO3 = Be (N03) 2 + H20
5. Be (NO3) 2 + 2KOH = Be (OH) 2 + 2KN03
6. Săptămâna Be (OH) 2 + 2KOH. = K2Be02 + 2H20
7.Be (OH) 2 + H2S04 = ZnS04 + 2H20
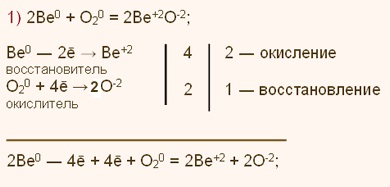
Demonstrați faptul că amfotericitatea confirmă relativitatea divizării elementelor în metale și nemetale.
Amfotericitatea confirmă natura relativă a diviziunii elementelor în metale și nemetale, deoarece oxizii și hidroxii amfoterici, în funcție de condiții, prezintă proprietăți acide sau de bază. Iar elementele care formează oxizi și hidroxizi amfoterici se numesc tranzitori.