3: Denumirea compușilor ionici Denumirea compușilor polihidrați Denumirea compușilor covalenți
Abilitatea de a da nume compușilor chimici de bază este o componentă necesară a unui studiu de succes al chimiei. Urmați acest ghid pentru a afla câteva reguli de bază pentru alocarea de denumiri compușilor chimici și, de asemenea, învățați cum să denumiți compușii chimici pe care i-ați văzut pentru prima dată.
Metoda 1 din 3: Denumirea compușilor ionici
Metoda 2 din 3: Numele compușilor poliatomici
- 1 Aflați ce este o conexiune poliatomică. Acești compuși constau din grupuri de atomi conectați unul la celălalt, întregul grup având o încărcare pozitivă sau negativă. Puteți efectua trei operații de bază cu conexiuni polatomice:
- Adăugați atomul de hidrogen la începutul compusului. Apoi, cuvântul "hidro" se adaugă la începutul denumirii compusului, care reduce încărcătura negativă cu 1. De exemplu, carbonatul "CO32" se va transforma în "hidrocarbonat" HCO3-.

- Îndepărtați oxigenul din compus. Încărcarea va rămâne aceeași, iar sfârșitul numelui conexiunii se va schimba de la "-at" la "-it". De exemplu: trecerea de la NO3 la NO2 este o tranziție de la "nitrat" la "nitrit".

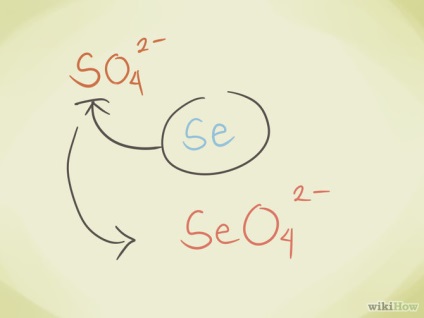
- Înlocuiți atomul central cu altul din același grup al sistemului periodic. De exemplu, sulfatul de SO42 poate deveni un selenat de SeO42-.
- Adăugați atomul de hidrogen la începutul compusului. Apoi, cuvântul "hidro" se adaugă la începutul denumirii compusului, care reduce încărcătura negativă cu 1. De exemplu, carbonatul "CO32" se va transforma în "hidrocarbonat" HCO3-.
- 2 Amintiți-vă de cele mai frecvente ioni complexe. Acești ioni sunt baza pentru formarea majorității denumirilor compușilor poliatomici. Acestea sunt enumerate mai jos, în ordinea cresterii tarifului negativ:

- Hidroxid: OH-
- Nitrat de ioni: NO3-
- Hidrocarbonat ion: HCO3-
- Permanganat ion: MnO4-
- Ion carbonat: CO32-
- Ion cromat: CrO42-
- Dicrom de ioni: Cr2O72-
- Sulfat ion: SO42-
- Ionul de sulfit: SO32-
- Tiosulfat ion: S2O32-
- Iona de fosfat: PO43-
- Amoniu de ioni: NH4 +
- 3 Scrieți numele conexiunilor pe baza acestei liste. Combinați numele unui element sau elemente asociate unui ion complex și denumiți conexiunea. Dacă elementul se confruntă cu un ion complex, numele elementului este pus pur și simplu după numele ionului.
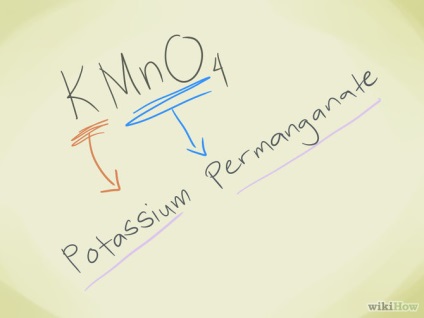
- Exemplu: KMnO4. Vedem că ionul MnO4- este un permanganat. K este potasiu, deci numele compusului este permanganatul de potasiu.
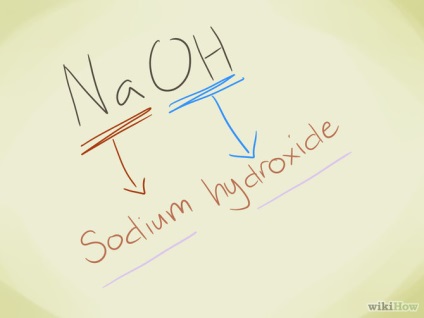
- Exemplu: NaOH. Vedem că OH- este un ion de hidroxid. Na este sodiu, așa că numele compusului este hidroxid de sodiu.
- Exemplu: KMnO4. Vedem că ionul MnO4- este un permanganat. K este potasiu, deci numele compusului este permanganatul de potasiu.
Metoda 3 din 3: Numele compușilor covalenți
- 1 Aflați ce este o legătură covalentă. Compușii covalenți sunt formați din două sau mai multe elemente nemetalice. Numele compusului se bazează pe numărul de atomi prezenți. Prefixul adăugat este un număr latin care caracterizează numărul de molecule.
- 2 Aflați prefixele. Rețineți prefixele pentru a indica numărul de atomi de la 1 la 8:
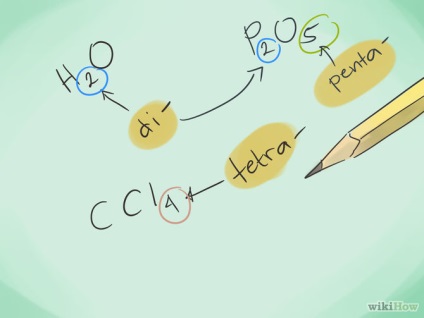
- 1 atom - "Mono-"
- 2 atomi - "Di-"
- 3 atomi - "Trei"
- 4 atomi - "Tetra-"
- 5 atomi - "Penta"
- 6 atomi - "hexa-"
- 7 atomi - "Hepta"
- 8 atomi - "Octa-"
- 3 Apelați conexiunile. Utilizând prefixele corespunzătoare, denumiți noua conexiune. Puteți adăuga un prefix la orice parte a conexiunii, în care există mai mulți atomi.
- Exemplu: CO este monoxid de carbon, iar CO2 este dioxid de carbon.

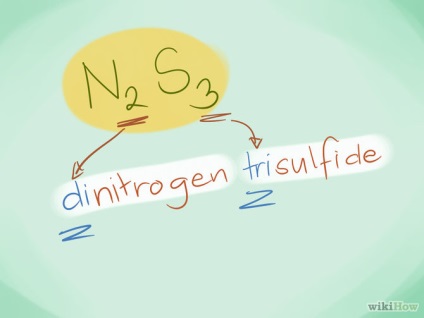
- Exemplu: N2S3 este trisulfura de diazotis.
- În majoritatea cazurilor, prefixul "mono" poate fi omis, deoarece este prefixul care nu este intenționat. Cu toate acestea, acest prefix este încă folosit pentru monoxidul de carbon în legătură cu utilizarea acestui termen de la vremurile de chimie timpurie.
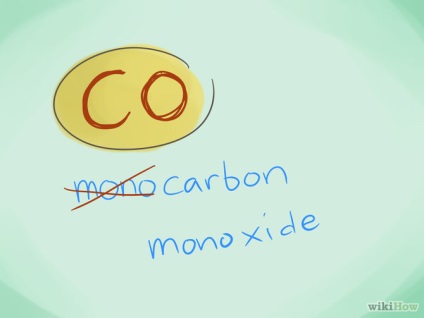
- Exemplu: CO este monoxid de carbon, iar CO2 este dioxid de carbon.
- Desigur, aceste reguli au o mulțime de excepții. De exemplu, în ciuda faptului că CaCl2 are doi atomi de clor, se numește clorură de calciu, mai degrabă decât diclorură de calciu, după cum se așteaptă.
- De asemenea, este important să înțelegeți că toate acestea nu se aplică chimiei organice.
- Aceste reguli sunt pentru persoanele care încep să studieze chimia și știința. Când ajungeți la nivelul avansat, veți afla că există și alte reguli, de exemplu regula variabilă de valență.