Tensiunea de suprafață este una dintre cele mai importante proprietăți ale sistemelor de dispersie și este principala caracteristică termodinamică a interfeței. Să luăm în considerare cel mai simplu caz - tensiunea superficială a unui lichid la limita cu un gaz (Figura 2.1).
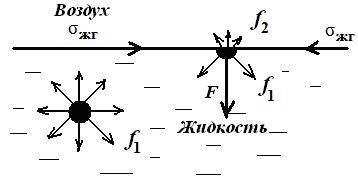
Fig. 2.1. Interacțiunea intermoleculară
în interiorul lichidului și la interfața de fază
Pe molecula din interiorul fluidului acționează forțele de atracție reciprocă (forța aderenței moleculare) de la toate moleculele vecine învecinate. Forța egală a acestor forțe este zero datorită simetriei câmpului de forță și pentru a mișca molecula din interiorul lichidului, nu este necesar să se cheltuiască munca. Acest lucru se datorează faptului că în faza gazoasă moleculele sunt separate unul de celălalt pe distanțe lungi, iar forțele de atracție reciprocă care acționează între ele sunt foarte mici. Moleculele situate la interfața dintre faze experimentează efectul forțelor intermoleculare într-o măsură mai mare față de faza lichidă f1. decât din partea gazului f2 (f1 >> f2). Forța rezultantă F, proporțională cu diferența de forță (f1-f2), este direcționată în fluid. Această forță pe unitate de suprafață (1 m 2 sau 1 cm 2) se numește presiunea internă (moleculară) pM:
Presiune moleculară determinată de puterea de molecule de adeziune, aceasta este cea mai mare a substanțelor polare, astfel încât cantitatea de H2O este de 14.000 atm pentru C6 H6 pM - 3800 atm. Astfel, orice lichid pe suprafață există o presiune mare datorită forțelor coezive moleculare decompensate în stratul de suprafață, și tinde să strânge toate moleculele de suprafață în faza lichidă. Aceasta explică forma sferică a picăturilor lichide.
Stratul de suprafață datorat forțelor moleculare necompensate are în exces energie liberă în comparație cu volumul lichidului. Acest exces de energie liberă, pe unitate de suprafață (1 m 2 sau 1 cm 2), se numește energia specifică a suprafeței libere (tensiunea superficială). Întregul surplus de energie de suprafață este închis într-o grosime a stratului 1 molecula. Prezența excesului de energie pe interfața de fază înseamnă că este nevoie de lucru pentru a forma o nouă suprafață.
Tensiunea de suprafață () este lucrarea unui proces izotermic reversibil petrecut pe formarea unei unități a interfeței de fază (determinarea energiei tensiunii de suprafață):
Un semn minus indică faptul că lucrările pozitive sunt efectuate atunci când suprafața este redusă sau redusă.
Definirea forței: tensiunea superficială este o forță orientată tangențial (paralelă cu suprafața) și pe unitatea de lungime a perimetrului care leagă această suprafață.
Esența fizică - moleculele de suprafață tind să treacă adânc în faza condensată, comprimând astfel suprafața.
Ambele definiții trebuie considerate în unitate. Această abordare unică a energiei și a puterii sa dezvoltat istoric. Tensiunea de suprafață a fost introdus fizica bine de energie înainte de conceptele și privit ca o forță de strângere un film ipotetic pe suprafața lichidului și se opune extensibilitate sale. Definirea forței este mai adevărată pentru lichide, deoarece ele concomitent cu formarea moleculelor de suprafață și atomii din ea sunt orientate, compactate, se deplasează într-o stare de echilibru și determinând astfel tensiunea superficială tangențial.
2.2.2. Definiție termodinamică
tensiunea superficială
Pentru p și T = const, scriem ecuația combinată a primului și a celui de-al doilea principiu al termodinamicii pentru un sistem eterogen cu privire la schimbarea energiei Gibbs:
unde T este temperatura; S este entropia; p este presiunea; V este volumul; s este suprafața; - tensiunea superficială; - potențialul chimic al componentei i; ni este numărul de moli ai componentei i; - potențialul electric; q este cantitatea de energie electrică.
Tensiunea de suprafață este o derivare parțială a energiei Gibbs pe suprafața interfeței de fază la presiune constantă, temperatură, număr de moli de componente și încărcare.
Deoarece ecuația combinată a primei și a doua legile termodinamicii și pot fi înregistrate la alte potențiale termodinamice, și anume interne de energie U. Helmholtz energie și entalpie A. H. apoi la parametrii constanți respectivi obținem
Tensiunea de suprafață este o derivare parțială a oricărui potențial termodinamic pe suprafața suprafeței interfazice la parametrii constanți corespunzători.
Cel mai adesea tensiunea de suprafață este exprimată în termeni de derivat al energiei Gibbs, deoarece Condițiile experimentale pentru constanța T și p sunt ușor de realizat experimental.
Tensiunea superficială a substanțelor individuale este în același timp energia specifică Gibbs a suprafeței (energia Gibbs pe unitatea de suprafață):