Subiectul temei: Proteine
să actualizeze cunoștințele despre proteine din cursul biologiei;
pentru a studia proprietățile fizice și chimice, reacțiile colorate ale proteinelor;
elevii ar trebui să poată caracteriza compoziția și structura proteinelor,
funcția de proteine în celulă, semnificația lor pentru viață.
Echipamente și reactivi: HNO3 concentrat. proteine, soluții de CuSO4. NaOH, lampă de alcool, potriviri, suport, tuburi de testare.
Proteine, conform lui F. Engels, una dintre formele existenței vieții.
„Oriunde vom găsi viața ne este asociat cu orice proteină a corpului, și ori de câte ori întâlnim orice organism de proteine, nu se află în procesul de descompunere, fără excepție, întâlnim fenomenul vieții.“ (K. Marx, F. Engels, Works Collected, vol. 20). Proteine - un material de construcție, funcționează motorul, catalitic de transport, de siguranță, funcția, energie.
Proteinele au fost izolate într-o clasă separată de molecule biologice in secolul al XVIII-lea, ca rezultat al activității chimist francez Antoine Fourcroy și alți oameni de știință, în care a fost observat proprietăți ale proteinelor coagulează (denaturează) sub influența căldurii sau a acizilor. În acel moment a fost investigat proteine cum ar fi albumina ( „ou alb“), fibrina (o proteină din sânge) și din gluten de grâu.
În anii optzeci ai secolului al XIX-lea, biochimistul rus Danilevsky A.Ya. Un pic mai târziu (în 1903) omul de știință german Fischer E. - a prezentat o teorie polipeptidică a structurii proteinelor: proteinele sunt legate într-un lanț de reziduuri # 945; - aminoacizi prin legături peptidice # 8213; CO # 8213; NH # 8213;
În prezent, 22 de aminoacizi sunt cunoscuți, ceea ce creează un număr mare de molecule de proteine. Și fiecare dintre ele are propria sa, strict definită ordine de alternare a aminoacizilor. Există patru structuri ale moleculei de proteine. Primare - alternarea reziduurilor # 945; - aminoacizi; lanțuri secundare, răsucite sub formă de spirală; tertiar - configurație, care ia în spațiu o spirală răsucite (asigură activitatea biologică a moleculei proteice); cuaternar - legate între ele cu macromolecule de proteine. Când este încălzit, agitat, structura terțiară a proteinei este distrusă, aceasta își pierde efectul biologic.
Proteinele sunt compuși naturali complexi, de mare moleculară, construiți din reziduuri # 945; - aminoacizi legați prin legături peptidice (amidă) # 8213; CO # 8213; NH # 8213;
Numărul de resturi de aminoacizi în structura moleculei de proteină, este diferită: în insulina 51 (20 în una și 31 - în alte lanțuri) în mioglobina - 140. Masele moleculare ale proteinelor pot varia de la 10.000 la mai multe milioane.
Mr (proteine din ouă) = 36.000; Mr (proteină musculară) = 1 500 000. Compoziția hemoglobinei este exprimată prin formula (C738 H1166 O208 N203 S2 Fe) 4. Nu este greu să se calculeze greutatea sa moleculară.
Proteinele sunt principalul purtător al vieții. Informațiile privind compoziția și structura proteinelor au fost obținute prin studierea produselor de hidroliză a acestora. S-a stabilit acum că moleculele majorității proteinelor constau în 22 de molecule diferite # 945; aminoacizi.
Compoziția proteinelor include: C - 50 - 52%; H - 6 - 8%; О - 19 - 24%; N- 15-18%; S 0,5 - 2,0%.
Cercetarea modernă ne permite să distingem structurile primare, secundare, terțiare și cuaternare în structura proteinelor. (Diapozitivul 6).
Structura primară a proteinei este secvența exactă a resturilor individuale de aminoacizi din macromolecule (toate legăturile sunt covalente, puternice). P.228 al manualului, figura 37.
Structura secundară este forma unui lanț polipeptidic în spațiu (cel mai adesea o spirală). Lanțul proteic este răsucite într-o spirală (datorită unui număr de legături de hidrogen).
Structura terțiară este o configurație reală tridimensională care apare atunci când lanțurile de polipeptide ale proteinelor sunt răsucite într-o spirală, care apare sub acțiunea disulfidelor, a hidrogenului și a altor legături.
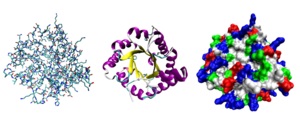
Moduri diferite de a descrie structura tridimensională a unei proteine.
Structura cuaternară este legătura între macromoleculele de proteine. Ele formează un complex. C.229, Fig.40.
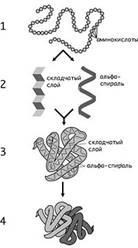
Nivelurile structurii proteinelor: 1 - primar; 2 - secundar; 3 - terțiar; 4 - cuaternar.
Multe proteine (globulare) sunt solubile în apă, soluții de săruri, acizi și aproape toți sunt dizolvați în alcalii; nu se dizolvă în solvenți organici; proteinele insolubile (fibrilare), din care sunt construite țesuturile organismelor vii (piele, tendoane, mușchi, unghii, păr), iar proteinele plasmatice sunt solubile.
1) hidroliza (cu încălzire cu soluții de acizi, alcalii, cu acțiunea enzimelor)
H2N # 8213; CH2 # 8213; C # 8213; # 8213; CH # 8213; C # 8213; # 8213; CH # 8213; C = O → H2N # 8213; CH2 # 8213; C = 0 +
H2O CH2H2O CH2OH OH
+ H2N # 8213; CH # 8213; C = 0 + H2N # 8213; CH # 8213; C = O
Hidroliza proteinelor reduce la hidroliza legăturilor polipeptidice. De asemenea, digestia proteinelor se reduce la aceasta:
Proteina ↔ aminoacizi → sânge în toate celulele și țesuturile corpului.
2) denaturare - o încălcare a structurii naturale a proteinei (sub influența încălzirii și reactivilor chimici)
Denaturarea găinilor de ou sub influența temperaturii înalte
__________ proprietățile acizilor
__________ proprietățile bazelor
4) reacții colorate ale proteinelor - reacții calitative
Experiența de laborator. Reguli de lucru!
a) reacția xantoproteinei.
Se toarnă niște proteine în eprubeta. Se adaugă 3-4 picături de acid azotic concentrat. Marcați modificările care au avut loc.
Proteină + HNO3 conc. → culoare galbenă
b) reacția biuret.
Se toarnă un pic de hidroxid de sodiu în tub, se adaugă o soluție de sulfat de cupru (II), astfel încât alcalina rămâne în exces. Se adaugă soluția proteică în precipitatul rezultat. Rețineți ce modificări s-au produs.
Proteină + Cu (OH) 2 ↓ → soluție de culoare violet.
Cum altfel puteți identifica proteina? (Arderea - mirosul de pene arse).
Concluzie: Calitatea proteinelor reacționează cu acid azotic concentrat (culoare galbenă) cu hidroxid de cupru proaspăt precipitat (II) (soluție violet) și proteinele de combustie (miros pene arse).
Dintre compușii organici care intră în celula vie, proteinele joacă un rol crucial. Acestea reprezintă aproximativ 50% din masa celulară.
Proteinele sunt materialele de construcție pentru membrană, organele și membranele celulare. Dintre acestea, au fost construite vasele de sânge, tendoanele și părul.
Ei efectuează o funcție catalitică. Toți catalizatorii celulari sunt proteine (situsuri active ale enzimei), structura centrului activ al enzimei și structura substratului corespund exact unul cu celălalt.
Proteinele contractile provoacă toate mișcările.
Proteinele îndeplinesc un rol de transport - hemoglobina din proteinele din sânge atasează oxigenul și transporta toate țesuturile.
Proteinele îndeplinesc o funcție protectoare - producția de corpuri proteice de anticorpi pentru neutralizarea substanțelor străine.
Odată cu descompunerea a 1 g de proteină, este eliberată energia de 17,6 kJ. (Proteinele se descompun la CO2, NH3, uree (NH2) 2CO și H2O).
În mușchi, - până la 80% în splină, sânge, plămâni - aproximativ 72% din piele - 63% în ficat - 57% din creier - 15%, tesutul adipos, tesutul osos si dintilor contin de la% proteine 14 la 28 .
Proteinele fac parte din multe medicamente. Se lucrează la producerea artificială de substanțe proteice (insulină, ribonuclează).
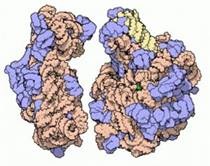
Modelul molecular al subunităților mici (stânga) și mari (dreapta) ale ribozomului bacterian - o mașină moleculară care sintetizează proteinele. Albastru prezintă proteinele din ribozom, dar ARNm joacă un rol structural important.
Acest lucru este important, deoarece experții Organizației Mondiale a Sănătății cred că aproximativ jumătate din populația lumii este într-o stare de foame de proteine, precum și lipsa mondială de proteine dietetice este de aproximativ 15 milioane de euro. Tone pe an, la rata de consumul de proteine la adult pe zi 115 de grame.
Am reamintit că ați știut despre proteine din cursul biologiei, ați examinat proprietățile chimice ale proteinelor, semnificația lor pentru viață. Vă sugerez să vă verificați cunoștințele anterioare răspunzând la întrebări. Trebuie să introduceți cuvintele sau expresiile lipsă.
Principalul purtător al vieții sunt ....
... sunt compuși macromoleculari complexi construiți din ....
Compoziția elementară a proteinelor: ....
Greutatea moleculară a proteinelor variază de la ... la ....
Multe proteine sunt solubile în ... aproape toate se dizolvă în ....
Proteine insolubile, din care ....
În structura proteinei, există ... structuri.
Funcțiile proteinelor din organism ....
proteine; soldurile # 945; aminoacizi.
Zece mii, milioane.
Apă, soluții de săruri, acizi; alcali.
Țesături de organisme vii: piele, tendoane, mușchi, unghii, păr.
Primară, secundară, terțiară, cuaternară.
Construcții, catalitice, propulsie, transport, apărare, energie.
"5" - toate răspunsurile sunt corecte; "3" - 3 răspunsuri incorecte;
"4" - 1-2 răspunsuri incorecte; "2" - 4 sau mai multe răspunsuri incorecte.
Proteinele sunt compuși naturali complexi, de mare moleculară, construiți din reziduuri # 945; - aminoacizi legați prin legături peptidice (amidă) # 8213; CO # 8213; NH # 8213;
Numărul de reziduuri de aminoacizi din moleculele de proteine variază: insulina este 51, mioglobina este 140. Mr (proteina) = de la 10.000 la câteva milioane.
Mr (proteine din ouă) = 36.000; Mr (proteină musculară) = 1 500 000.
Secvență primară - alternanța resturilor de aminoacizi (toate legăturile sunt covalente, puternice).
Secundar - forma lanțului polipeptidic în spațiu (cel mai adesea o spirală). Lanțul proteic este răsucite într-o spirală (datorită unui număr de legături de hidrogen). Tertiarul este o configurație reală tridimensională, care este presupusă în spațiu de o spirală răsucită (datorită legăturilor hidrofobe), pentru unele legături S-S (legături bisulfidice).
Cuaternar - legate între ele cu macromolecule de proteine.
1) hidroliza (cu încălzire cu soluții de acizi, alcalii, cu acțiunea enzimelor)
H2N # 8213; CH2 # 8213; C # 8213; # 8213; CH # 8213; C # 8213; # 8213; CH # 8213; C = O → H2N # 8213; CH2 # 8213; C = 0 +
H2O CH2H2O CH2OH OH
+ H2N # 8213; CH # 8213; C = 0 + H2N # 8213; CH # 8213; C = O
Hidroliza proteinelor reduce la hidroliza legăturilor polipeptidice. De asemenea, digestia proteinelor se reduce la aceasta:
proteine ↔ aminoacizi → sânge în toate celulele și țesuturile corpului.
2) denaturare - o încălcare a structurii naturale a proteinei (sub influența încălzirii și reactivilor chimici)
__________ proprietățile acizilor
| __________ proprietățile bazelor
4) reacții colorate ale proteinelor - reacții calitative
a) reacția xantoproteinei.
Proteină + HNO3 conc. → culoare galbenă
b) reacția biuret.
Proteină + Cu (OH) 2 ↓ → soluție de culoare violet.
c) arderea - mirosul de pene arse.
Concluzie: Calitatea proteinelor reacționează cu acid azotic concentrat (culoare galbenă) cu hidroxid de cupru proaspăt precipitat (II) (soluție violet) și proteinele de combustie (miros pene arse).
Rolul proteinelor în celulă.
1. Materialul de construcție - formarea cochiliei, organoizilor și membranelor celulare. Vasele sanguine, tendoanele, părul au fost construite.
2. Rolul catalitic - toți catalizatorii proteinelor celulare.
3. Funcția motorului - proteinele contractile provoacă toate mișcările.
4. Funcția de transport - hemoglobina din proteinele din sânge atasează oxigenul și transporta toate țesuturile.
5. Rolul de protecție - producerea de corpuri proteice de anticorpi pentru neutralizarea substanțelor străine.
6. Rolul energiei: 1 g de proteină → 17,6 kJ.