În soluri, după un anumit timp de așezare a particulelor, uneori foarte lung, poate să apară o perioadă în care fluxul de difuzie devine egal cu sedimentarea iiff = iSed. și anume va exista un echilibru de difuzie-sedimentare. Deoarece un astfel de echilibru se situează la un anumit gradient de concentrație, distribuția corespunzătoare a fazei dispersate de-a lungul înălțimii trebuie stabilită în sistem. Pentru a determina legea acestei distribuții, folosim această relație (idif = ised), ținând seama de aceasta
și înlocuirea lui x cu h (distanța în înălțime):
După separarea variabilelor, obținem:
Integrarea în intervalul de la ν0 la νh și de la h = 0 la h, respectiv, găsim:
Această ecuație se numește lege hypsometrică (de la laturile Hypsos - înălțime).
Dacă comparați sedimentarea în prezența difuziei și fără ea, atunci atenția este atrasă asupra diferenței de factori care asigură stabilitatea sistemelor de dispersie până la stabilitatea sedimentării - sedimentării. Acești factori fac posibilă diferențierea între stabilitatea sedimentării cinetice (CCS) și stabilitatea termodinamică de sedimentare (TSS).
Măsura stabilității de sedimentare cinetică este inversul constantei de sedimentare:
Măsura TSU este înălțimea hypsometrică. Este mai convenabil să-l definiți ca înălțimea. în care concentrația fazei dispersate se modifică cu un factor de e.
Această formulă arată că înălțimea și respectiv hipsometric stabilitatea termodinamică sedimentare este mai mare, mai mică dimensiunea particulelor și diferența dintre densitățile particulelor și a mediului. Viscozitatea nu afectează TAS, în timp (în același timp, contribuie la creșterea stabilității temperaturii, deoarece mișcarea termică îmbunătățită. Stabilitatea sedimentare cinetică cu creșterea temperaturii scade, de obicei, datorită vâscozității reduse a mediului.
Electroforeza dispersiei lutului bentonit are loc în următoarele condiții: distanța dintre electrozi este de 25 cm, tensiunea este de 100 V, timp de 15 minute particulele sunt deplasate 11 mm la anod. Calculați potențialul ζ, luând în considerare faptul că ε = 78,2 și η = 9,9 · 10-4 Pa · s.

Numărul biletului de examinare 8
Clasificarea mecanismelor de adsorbție. Natura forțelor de adsorbție și caracteristicile lor în adsorbția fizică. Derivarea ecuației pentru energia interacțiunii de dispersie a atomului adsorbant cu adsorbantul. Izotermă, izostere, adsorbție izopică.
Procesele de adsorbție sunt clasificate în funcție de tipul de interacțiune a adsorbatului cu adsorbantul. Clasificarea fizicochimic se bazează pe premisa că redistribuirea componentelor între faza compactă și stratul de suprafață poate avea loc sub influența forțelor fizice sau prin reacția chimică dintre adsaorbatelor și adsorbant. Reacția chimică în acest caz poate fi reprezentată fie ca o adăugare chimică a atomilor (moleculelor), fie ca o interacțiune de schimb ionic. Astfel, conform clasificării fizico-chimice distinge fizică adsorbție (molecular), chemisorption (atașarea chimică a atomilor, molecule) și schimbătoare de ioni.
În cazul adsorbției fizice, interacțiunea adsorbantului și adsorbatului se realizează datorită forțelor van der Waals și legăturilor de hidrogen. Aceste forțe de adsorbție asigură atragerea atomilor (moleculelor); la o distanță foarte scurtă, se manifestă forțe repulsive cu rază scurtă de acțiune.
În timpul adsorbției chimice, se formează o legătură chimică între adsorbant și adsorbant și își pierde individualitatea.
Pentru moleculele cu momente dipol mici, principala contribuție la energia de interacțiune se face prin forțele de dispersie. Este caracteristic faptul că pentru toate cele trei componente ale forțelor Van der Waals, aceeași lege de variație a energiei de atracție de la distanță este satisfăcută :.
Deoarece energia interactivă totală pentru adsorbția Uads este determinată de suma energiei de interacțiune a atomului adsorbit cu toți atomii din volumul adsorbantului,
Cantitatea dV poate fi determinată prin suprafața segmentului sferic:
Se integrăm în intervalul de la r = x la r = ∞ și în final obținem:
Dependența adsorbției de concentrația (sau presiunea parțială) a substanței la o temperatură constantă se numește izotermă de adsorbție.
Dependența adsorbției de temperatura la o concentrație constantă (sau o presiune parțială) a substanței se numește adsorbție izopică (sau izobar).
Dependența concentrației (sau a presiunii parțiale) a substanței în volum la temperatura la o valoare constantă de adsorbție se numește un izostere de adsorbție.
Două tipuri de stabilitate a sistemelor de dispersie. Sisteme liofilice și lyofobe. Criteriul de liofilicitate și lyofobicitate conform lui Rebinder-Shchukin. Factorii termodinamici și cinetici ai stabilității sistemelor de dispersie.
La sugestia lui NP Peskov, stabilitatea sistemelor de dispersie este împărțită în două tipuri: stabilitate la precipitarea fazei dispersate și stabilitate la agregarea particulelor sale. Primul tip de stabilitate caracterizează capacitatea unui sistem de dispersie de a menține o distribuție uniformă a particulelor într-o fază dispersată asupra volumului unui mediu de dispersie sau a rezistenței sale la stabilitatea de separare a fazei-sedimentare. Cel de-al doilea tip de stabilitate este stabilitatea agregată (stabilitatea la lipire) a sistemelor de dispersie.
Toate dispersiile conform procesului de formare a lor clasificare mecanism P. Rebinder împărțit în liofilici, care se obțin prin dispersia spontană a unei faze (heterogen svobodnodispersnoy sistem de formare spontană) și lyophobic, dispersia rezultată cu suprasaturare și condensare (forțat formarea unui sistem eterogen de dispersie liberă).
Există factori termodinamici și cinetici ai stabilității agregate a sistemelor de dispersie. Deoarece forța motrice este excesivă de energie de suprafață de coagulare, principalii factori care asigură stabilitatea sistemelor disperse (menținând în același timp mărimea suprafeței), vor fi cele care reduc tensiunea superficială. Acești factori sunt denumiți termodinamici. Acestea reduc probabilitatea coliziunilor efective între particule, creează bariere potențiale care încetinesc sau chiar exclud procesul de coagulare.
Factorii cinetici care reduc rata de coagulare sunt asociate în principal cu proprietățile hidrodinamice ale mediului: cu încetinirea apropierii particulelor, a ieșirii și distrugerii straturilor intermediare între ele.
Distingem următorii factori termodinamici și cinetici ai stabilității sistemelor de dispersie:
1. Factorul electrostatic constă în reducerea tensiunii interfațiale datorită apariției unui strat dublu electric pe suprafața particulelor în conformitate cu ecuația Lippmann.
2. Factorul de adsorbție-solvat constă în reducerea tensiunii interfațiale în timpul interacțiunii particulelor fazei dispersate cu mediul (datorită adsorbției și solvatării)
3. Factorul de entropie, ca și primele două, se referă la factorii termodinamici. Acesta completează primii doi factori și operează în sisteme în care particulele sau straturile lor de suprafață participă la mișcarea termică.
4. Factorul structural-mecanic este cinetic. Acțiunea sa se datorează faptului că pe suprafața particulelor există filme care au elasticitate și rezistență mecanică, distrugerea cărora necesită energie și timp.
5. Factorul hidrodinamic reduce viteza de coagulare datorită unei modificări a vâscozității mediului și a densității fazei dispersate și a mediului de dispersie.
6. Factorii diferiți sunt cei mai tipici pentru sistemele reale. De obicei, stabilitatea agregată este furnizată simultan de mai mulți factori.
Starea stabilității agregatelor termodinamice a unui sistem de dispersie poate fi scrisă după cum urmează:
Aceasta înseamnă că energia Gibbs nu trebuie să crească cu o creștere a suprafeței interfațiale (la o tensiune interfacială constantă) sau cu o diminuare a dimensiunii particulelor. Suprafața interfazică poate crește spontan numai dacă energia de suprafață este compensată de o creștere a entropiei sistemului. Acest fenomen se numește dispersie spontană.
Din aceste poziții urmează ecuația de dispersie spontană a Rebinder-Schukin:
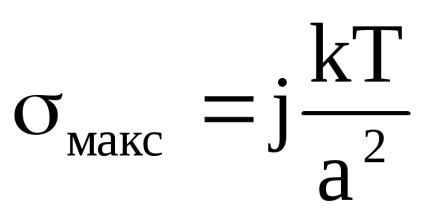
Folosind legea hypsometrică, se calculează pentru înălțimea solului Al2O3, la care concentrația particulelor scade cu un factor de e. Acceptați această formă de particule sferice, suprafața specifică a fazei dispersate 3 x 103m-1, densitate Al2O34000 kg / m3, densitatea mediului de dispersie de 1000 kg / m3, temperatura de 20 ° C
