Informații generale privind structura atomului de oxigen
Oxigenul este al optulea element al tabelului periodic. Se referă la metale nemetalice. Se află în a doua perioadă a grupului VI A al subgrupului.
Numărul secvenței este 8. Încărcarea kernelului este de +8. Greutatea atomică este de 15999 amu. În natură, există trei izotopi de oxigen: 16 O, 17 O și 18 O, dintre care cea mai comună este 16 O (99,762%).
Structura electronică a atomului de oxigen
Atomul de oxigen are două cochilii, la fel ca toate elementele situate în a doua perioadă. numărul grupului -VI (calcogenuri) - sugerează că extern este de 6 electroni de valență ale nivelului electronic al atomului de azot. Are o capacitate mare de oxidare (mai mare doar în fluorură).
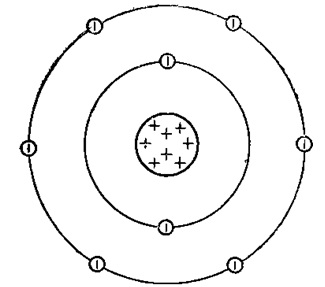
Fig. 1. Reprezentarea schematică a structurii atomului de oxigen.
Configurația electronică a stării solului este scrisă după cum urmează:
Oxigenul este un element al familiei p. Schema de energie pentru electronii de valență în stare neașteptată este după cum urmează:
Oxigenul are 2 perechi de electroni perechi și doi electroni nepartiți. În toți compușii săi, oxigenul prezintă o valență II.
Fig. 2. Reprezentarea spațială a structurii atomului de oxigen.