Masa moleculară a acidului azotic
Acidul azotic în condiții obișnuite este un lichid incolor (densitate 1,52 g / cm3) care fierbe la 82,6 ° C și la o temperatură (-41,6 ° C) solidificând într-o masă cristalină transparentă.
Structura moleculei de acid azotic este prezentată în Fig. 1. Se amestecă cu apă în orice raport. Este un electrolit puternic, adică în soluție apoasă aproape complet disociază în ioni. În IVP se manifestă în rolul unui oxidant.
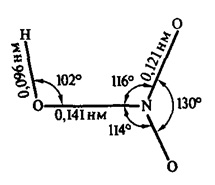
Fig. 1. Structura moleculei de acid azotic cu indicarea unghiurilor de valență între legături și lungimile legăturilor chimice.
Formula brută de acid azotic este HNO3. După cum se știe, greutatea moleculară a moleculei este suma maselor relative atomice ale atomilor cuprinzând molecula (valorile masei atomice relative luate din Mendeleev Tabelul periodic sunt rotunjite la întregi).
Mr (HNO3) = Ar (H) + Ar (N) + 3x Ar (O);
Domnul (HNO3) = 1 + 14 + 3 × 16 = 1 + 14 + 48 = 63.
Masa moleculară (M) este masa de 1 mol de substanță. Este ușor să se arate că valorile numerice ale masei moleculare M și ale masei moleculare relative sunt egale, dar prima cantitate are dimensiunea [M] = r / mol, iar a doua dimensiune este fără dimensiuni:
Aceasta înseamnă că masa molară de acid azotic este de 63 g / mol.
Exemple de rezolvare a problemelor
Prepararea compusului cu formula de magneziu, sulf și oxigen, în cazul în care raportul masic al elementelor în ea m (Mg): m (S): m (O) = 3: 4: 8.
Pentru a cunoaște în ce legătură se află elementele chimice din moleculă, este necesar să găsim cantitatea de materie. Se știe că pentru a găsi cantitatea unei substanțe, formula trebuie utilizată:
Am găsit masa molară de magneziu, sulf și oxigen (mase atomice valori relative luate din Mendeleev Tabelul periodic sunt rotunjite la întregi). Este cunoscut faptul că M = dl, înseamnă (Mg) = 24 g / mol, M (S) = 32 g / mol și M (O) = 16 g / mol.
Apoi, valoarea materiei acestor elemente este egală cu:
n (Mg) = m (Mg) / M (Mg);
n (Mg) = 3/24 = 0,125 mol.
n (S) = 4/32 = 0,125 mol.
n (0) = 8/16 = 0,5 mol.
Să găsim raportul molar:
n (Mg): n (S): n (0) = 0,125: 0,125: 0,5 = 1: 1: 4.
și anume formula pentru combinația de magneziu, sulf și oxigen este MgS04. Acesta este sulfatul de magneziu.
Se compune formula pentru conectarea sulfului cu oxigen, dacă fracțiile de masă ale elementelor din el: ω (S) = 40%, ω (O) = 60%.
Fracțiunea de masă a elementului X din molecula compoziției HX se calculează după următoarea formulă:
ω (X) = nx Ar (X) / M (HX) x 100%.
Să desemnem numărul de moli ai elementelor care compun compusul pentru "x" (sulf) și "y" (oxigen). Apoi, raportul molar va arăta astfel (valorile masei atomice relative luate din tabelul periodic al lui DI Mendeleev sunt rotunjite la întregi):
x: y = ω (S) / Ar (S). ω (O) / Ar (O);
x: y = 1,25. 3,75 = 1,3.
Prin urmare, formula pentru conectarea sulfului cu oxigen va avea forma SO3. Acesta este oxidul de sulf (VI).