Ecuații de reacție a raportului de metale:
- a) la substanțe simple: oxigen, hidrogen, halogeni, sulf, azot, carbon;
- b) substanțe complexe: apă, acizi, alcalii, săruri.
- Metalele includ s-elemente din grupele I și II, toate elementele s, elementele p ale grupului III (cu excepția borului), precum și staniu și plumb (grupa IV), bismut (grupa V) și poloniu (grupa VI). Metalele în majoritate au un nivel de energie extern de 1-3 electroni. La atomii de d-elemente în perioadele de la stânga la dreapta, d-subvelirile stratului pre-existent sunt umplut.
- Proprietățile chimice ale metalelor se datorează structurii caracteristice a cochililor de electroni externi.
În perioada în care încărcătura nucleară crește, razele atomilor cu același număr de cochilii de electroni scad. Cele mai mari raze sunt atomii de metale alcaline. Cu cât raza atomului este mai mică, cu atât este mai mare energia de ionizare și cu cât este mai mare raza atomului, cu atât este mai mică energia de ionizare. Deoarece atomii de metal au cele mai mari raze de atomi, ele sunt caracterizate în principal prin valori scăzute ale energiei ionizării și afinității electronilor. Metalele libere prezintă proprietăți extrem de reduse.
3) Metalele formează oxizi, de exemplu:
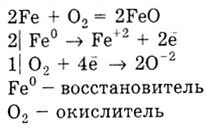
Numai metalele alcaline și alcalino-pământoase reacționează cu hidrogenul, formând hidruri:
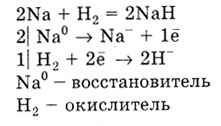
Metalele reacționează cu halogeni, formând halogenuri, cu sulfuri de sulf, cu nitruri de azot, cu carburi de carbon.


Cu creșterea valorii algebrice a potențialului electrod standard al metalului E 0 în seriile de solicitări, abilitatea metalului de a reacționa cu apa scade. Astfel, fierul reacționează cu apa numai la o temperatură foarte ridicată:
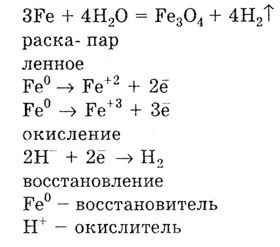
Metalele cu o valoare pozitivă a potențialului electrodului standard, care staționează după hidrogen într-o serie de tensiuni, nu reacționează cu apa.
Reacții caracteristice ale metalelor cu acizi. Metalele cu o valoare negativă a E 0 înlocuiesc hidrogenul din soluțiile de HCl, H2SO4. H3PO4, etc.
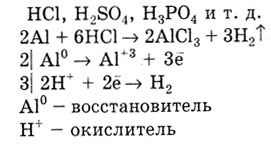
Un metal cu o valoare mai mică de E 0 deplasează un metal cu o valoare mare de E 0 din soluțiile de sare:
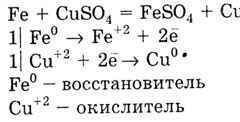
Compușii cei mai importanți de calciu obținuți în industrie, proprietățile lor chimice și metodele de producție.
a) reacționează cu apa cu eliberarea unei cantități mari de căldură:
CaO + H20 = Ca (OH) 2 (var hidratat).
b) reacționează cu acizi, formând sare și apă:
CaO + 2H + = Ca2 + + H20
c) reacționează cu oxizi acide pentru a forma o sare:
Hidroxidul de calciu Ca (OH) 2 este folosit sub formă de var cald, lapte de var și apă de var.
Varful de lapte este o suspensie formată prin amestecarea excesului de var stins cu apă.
Apa de var este o soluție limpede obținută prin filtrarea laptelui de var. Utilizat în laborator pentru a detecta monoxidul de carbon (IV).
Ca (OH) 2 + C02 = CaC03 + H20
Atunci când monoxidul de carbon (IV) trece mult timp, soluția devine transparentă, deoarece se formează o sare acidă, solubilă în apă:
Dacă soluția transparentă rezultată de carbonat acid de calciu este încălzită, atunci turbiditatea apare din nou, deoarece precipită CaCO3 precipită.