Fiecare element are o caracteristică numai pentru distribuția electronilor în atomi și, prin urmare, pentru un aranjament complet specific al nivelurilor de energie electronică. Prin urmare, rezultă că lungimile de undă și frecvențele radiației absorbite sau emise în timpul procesării electronilor de la un nivel de energie la altul sunt, de asemenea, complet individuale pentru fiecare element. Această individualitate este baza spectroscopiei atomice. Mai jos, spectrul atomic al emisiei de hidrogen va fi luat în considerare în detaliu și se va arăta cum este legată de nivelurile de energie ale electronului la un atom de hidrogen. Individualitatea distribuirii electronilor și a nivelului lor de energie în atomii fiecărui element particular este larg folosită în practică. Luați în considerare, de exemplu, iluminarea fluorescentă și un laser.
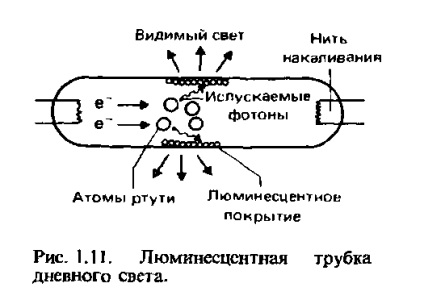
Iluminarea fluorescentă. Luminescența este un fenomen destul de comun; un caz particular al fluorescenței sale. În Fig. 1.11 prezintă schema dispozitivului unui tub de iluminare fluorescentă. În acest tub sunt vapori de mercur la presiune scăzută. Cu un fir fierbinte pe un capăt al tubului, electronii intră în el. Confruntate cu atomi de mercur, ele excită electronii acestor atomi la niveluri mai mari de energie. Atunci când electronii excitați revin la niveluri mai scăzute de energie, fotoni de lumină ultravioletă sunt emise. Fotonii se ciocnesc cu atomi, care formează un strat luminiscent pe suprafața interioară a tubului. Electronii din acești atomi devin excitați. Apoi se întorc la niveluri mai scăzute de energie, emite radiații, caracteristice pentru substanța din care constă acoperirea. Acoperirile de diferite tipuri permit o iluminare a diferitelor culori.
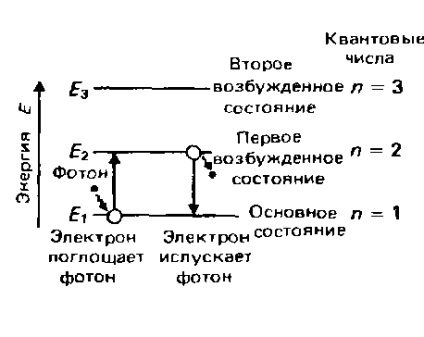

Unele substanțe emit lumină vizibilă atunci când sunt excitate de lumina ultravioletă sau de alte tipuri de radiații. Acest fenomen se numește luminescență. Radiația excitantă determină ca electronii din atomi, ioni sau molecule ale materiei să intre în stări excitate. Când electronii revin la starea lor de bază, ei emite lumină vizibilă.
Dacă revenirea la starea solului are loc imediat după excitație, atunci acest fenomen se numește fluorescență. Totuși, dacă electronii rămân în stări excitate și emit lumină numai după o anumită perioadă de timp, fenomenul este numit fosforescență.
Reacțiile chimice ale anumitor compuși, cum ar fi luminol (5-ami no-2,3-dihidro-1,4-phthalazinedione), urmată de chemoluminiscență.
Intensitatea și natura chemiluminescenței depind de factori precum concentrația reactivilor, pH-ul mediului și prezența catalizatorului.
Printre soiurile de luminiscență observate în natură este fulgerul. Lightning-ul este un exemplu de electroluminescență. Anumite tipuri de bacterii, crustacee, pești, ciuperci, meduze, moluște, protozoare, bureți și viermii au capacitatea de a străluci. Probabil cele mai cunoscute exemple de animale care pot străluci sunt licuricii. Acest fenomen se numește bioluminescență sau lumină "vie". Este cauzată de reacția oxigenului cu substanța din organism, numită luciferină. Această reacție este catalizată de enzima luciferază. Mamifere, păsări, reptile, amfibieni și plante cu frunze căzătoare nu prezintă luminescență.
Probele unor minerale, cum ar fi, de exemplu, fluoritul CaF2, fluoresc sub iluminare cu radiații ultraviolete. Prezența sau absența fluorescenței în fiecare probă particulară depinde de compoziția exactă a mineralelor.
Bariitul mineral, constând în principal din sulfat de bariu BaSO4, are proprietatea de a straluce în întuneric, dacă este preîncălzit la o temperatură sub căldura roșie. Acest fenomen se numește termoluminescență.
Luminescența trebuie distinsă de strălucirea de temperatură care provine de la corpuri încălzite la temperaturi foarte ridicate, adică ca urmare a incandescenței.
Laserul. Mai sus sa indicat că, atunci când electronii în stare excitată revenirea la niveluri mai mici de energie, această tranziție este însoțită de o emisie de fotoni cu o lungime de undă caracteristică (așa-numita emisie stimulată). (Acest proces în fiecare dintre atomii apar mai devreme sau mai târziu, în mod spontan, dar fotonii emiși de un atom, alți atomi sunt forțați să emită radiații sale, mai degraba stimula sa-Trans.)
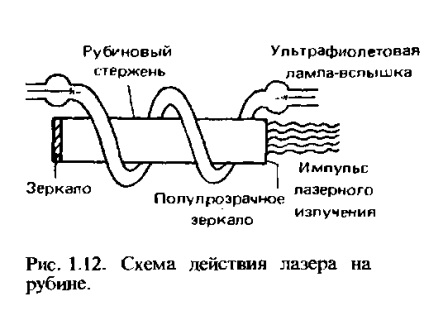
Cuvântul "laser" este o abreviere a cuvintelor în limba engleză, ceea ce înseamnă "amplificarea luminii prin emisia stimulată de radiație". Cel mai simplu laser constă din trei părți: o tijă rubinie, o lampă cu bliț și o pereche de oglinzi, între care! există o tijă de rubin; Rolul acestor oglinzi se realizează prin reflectarea acoperirilor metalice aplicate la capetele tijei (Figura 1.12). Una dintre acoperiri este făcută translucidă.
O aprindere a unei lămpi ultraviolete pulsate excită electronii într-o nouă tijă de rubinie. Unii dintre electronii excitat imediat și auto-fiabil reveni la niveluri mai mici de energie. În același timp, ele emit fotoni. Acești fotoni se reflectă în interiorul tijei rubinului prin învelișurile oglinzilor la capete și stimulează emiterea de fotoni de către alți atomi excitați. Apare o reacție în lanț, care duce la faptul că toți electronii care rămân excitați practic simultan revin la cele mai scăzute niveluri de energie. Aceasta conduce la apariția unei lumini extrem de intense și puls de lumină având o direcție și o frecvență strict definite. Deoarece unul dintre straturile de oglindă ale tijei este translucid, permite pulsul luminii să iasă.