Sponsorul concursului este compania Life Technologies.
Totul a început cu faptul că, în secolul XX, oamenii de știință au devenit interesați de natura bolilor umane și animale neobișnuite: kuru. Creutzfeldt-Jakob. scrapie. Simplitatea marcată a patologiei acestor boli a dat naștere unei ipoteze despre infecțiozitatea lor, care a fost ulterior confirmată experimental. Apoi a apărut întrebarea despre agentul cauzal al acestor boli. Înainte de a fost găsit răspunsul, au fost identificate proprietățile neobișnuite ale agenților patogeni: ele nu cresc pe medii artificiale, rezistente la temperaturi ridicate, formaldehidă, diferite tipuri de radiații, nucleaze. Curățarea materialului infecțios și studiul a permis să proclame că „vina“ de proteine, care acum 30 de ani a fost numit un prion (de la angl.pr [infect otenacious] ion - infecția proteine).
Figura 1. Metafora afectării cerebrale neurodegenerative este un burete în care țesutul neural este transformat ca rezultat al morții în masă a neuronilor.
Esența biologică a prionilor
Molecula prionică nu este ceva exotic: în forma "normală" se află pe suprafața nervilor fiecăruia dintre noi. În același timp, ne simțim minunați și celulele noastre nervoase sunt vii și bine. Totuși, acest lucru este până când proteina noastră normală este "rebornată" într-o formă anormală. Și dacă acest lucru se întâmplă, aceasta va conduce la consecințe dezastruoase: forma infectioasa de prionice tinde să se „lipească între ele“, cu alte molecule și, în plus, „converti“, le în aceeași formă, provocând o „epidemie moleculara.“ Ca rezultat al acestei polimerizări, pe celula nervoasă apar plachete toxice de proteine *, care pierde [1]. La locul celulei moarte se formează un vacuol, un vacuol umplut cu lichid. Odată cu trecerea timpului va dispărea unul câte un neuron si creier - pentru a forma mai multe „găuri“, până când în cele din urmă, creierul nu se transformă într-un burete (figura 1), pentru ceea ce va fi în mod inevitabil, urmată de moarte.
* - Există o viziune simplificată că fibrele polimerizate prionice "străpung" neuronul, ceea ce provoacă moartea acestuia. De fapt, acest lucru nu este adevărat: etapa anterioară fibrilară agregate sferice de prioni au, de asemenea, toxicitate (cel puțin, pentru boala Alzheimer): „neurotoxină Alzheimer:. Otrăvitoare nu numai fibrile“ Ed.
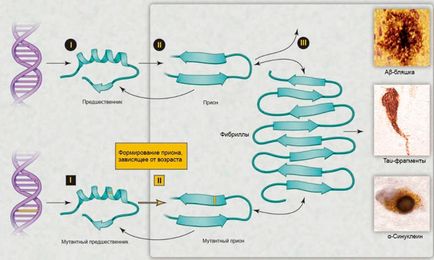
Dar cum poate o proteină naturală normală (notat PrP C) devin brusc patologică (PrPSc, Sc - de la cuvântul «scrapie»)? Ce ar trebui să se întâmple? Ca și în cazul infecțiilor „obișnuite“, pentru această transformare trebuie să fie îndeplinite cu o molecula de prionice infectioase. Există două moduri de transmitere a acestei molecule: ereditare (datorate mutatii ale genei care codifică proteina) și infecția. Aceasta este, introducerea poate avea loc în mod neașteptat prion - de exemplu, prin consumul de carne insuficient prăjită sau fierte (care trebuie să fie prezente sub formă de PrPSc), transfuzii de sânge, transplant de organe și țesuturi, atunci când este administrat la un hormoni animal de origine hipofizară.
Apoi apare un eveniment uimitor: moleculele normale de proteine, în contact cu cele patologice, se transformă în ele, schimbă structura lor spațială (mecanismul transformării rămâne un mister până în prezent) [1]. Astfel, prionul, ca agent real infecțios, infectează moleculele normale, declanșând o reacție în lanț, distrugătoare pentru celulă.
Unele informații despre prioni
- Proteina Prion include 254 de resturi de aminoacizi și "cântărește" 33-35 kilodaltoni [2];
- Gena care codifică proteina PrP se găsește la oameni, mamifere și păsări [1];
- Pentru a distruge complet proteina prionică, este necesară o temperatură de cel puțin 1000 de grade [1]!
- Poate că prionii participă la recunoașterea intercelulară și la activarea celulară [3];
- Nu este exclus faptul că funcția prionilor este suprimarea proceselor de vârstă [3];
- Odată cu dezvoltarea manifestărilor clinice ale bolilor prionice, nu există semne de inflamație sau modificări ale sângelui;
- Se presupune că prionii participă la dezvoltarea schizofreniei și miopatiei;
- Mecanismul de acțiune al prionilor și transformarea lor de la forma normală la patologia rămâne neclar.
Condiții de apariție a bolilor
Condițiile de apariție a bolilor prionice sunt unice. Ele pot fi formate în trei scenarii: leziuni infecțioase, sporadice și ereditare. În ultima variantă, rolul principal este jucat de predispoziția genetică [2].
În ultimul deceniu, interesul pentru acest subiect a fost reînnoit în legătură cu posibilitatea dezvoltării unor diagnostice și a unei terapii eficiente [5]. Au apărut numeroase explicații pentru bolile neurodegenerative legate de vârstă, de exemplu modificarea oxidantă a ADN-ului, a lipidelor și / sau a proteinelor; mutații somatice; imunitate congenitală modificată; toxine exogene; inconsistențe în ADN-ARN; perturbarea muncii chaperonilor; absența uneia dintre alelele genei [5]. O explicație explicativă alternativă este că diferite grupuri de proteine pot forma prioni. În ciuda faptului că o cantitate mică de prioni pot fi eliminate prin cai de proteine de degradare, acumularea lor excesive, ceea ce duce la o perturbare a sistemului nervos central [5] în timp permite prionii distribuite independent în corp (Fig 2.).
Grupuri cu risc de boli prionice
Asta poate provoca bolile prionice cu cea mai mare probabilitate:
- Lucrători în industria alimentară;
- medicilor veterinari;
- patologi;
- chirurgi;
- Pacienții transplantului;
- canibali;
- Persoanele ale căror familii au prezentat sindroame Gerstmann-Streisler-Sheinkler sau insomnie fatală.
Diagnosticul și tratamentul de laborator
Diagnosticul se bazează pe infecția intracerebrală a șoarecilor sau a hamsterilor, în care o boală corespunzătoare se dezvoltă lent (până la 150 de zile) dacă bolnavul a fost bolnav [2]. Este adesea efectuată o examinare histologică a creierului animalelor moarte [2].
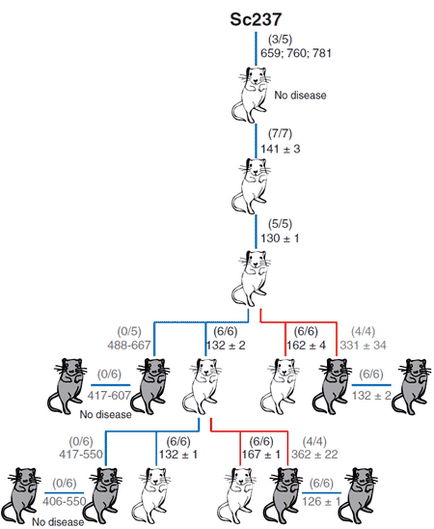
Figura 3. Capacitatea de prioni Sc237 infecta hamsteri și transmise atunci când este administrat la creier sau splina șoarecilor transgenici care poartă proteina PrP oi prionice (tg338; șoarece alb) sau uman (TG7; șoarece gri). Numărul de șoareci bolnavi / injectați este prezentat în paranteze; Mai jos este durata medie de viață (în zile). Cifra de la [6].
Din păcate, nu s-au dezvoltat încă metode eficiente pentru tratarea bolilor prionice, deși se fac încercări de prevenire a tranziției conformaționale a unei proteine normale la o proteină anormală. Prin urmare, cea mai fiabilă modalitate de a preveni dezvoltarea formelor infecțioase este prevenirea [2].
Deosebit de relevant este decizia "întrebării prionice" în legătură cu amenințarea crescândă a epidemiei prin operații medicale invazive și chiar și atunci când se iau medicamente.
perspective
Aparent, interesul pentru prioni nu va disparea până când ipotezele din contul lor nu vor fi confirmate pe deplin și vor fi găsite metode eficiente de tratare a bolilor prionice. Articolul [6] vorbește despre necesitatea unui studiu modern, care necesită o examinare atentă a prionilor străini în țesuturile extravineuronale.
De ce această replicare preferată a prionilor în țesuturile limfatice nu este încă cunoscută. Cu toate acestea, datele obținute arată că o persoană poate fi mai sensibilă la prioni străini decât sa crezut anterior bazată pe prezența prionilor din creier și, din acest motiv, vectorul asimptomatic al bolii prionice nu poate fi recunoscut. Acest lucru confirmă încă o dată faptul că o astfel de biomolecule puternică ca prion este plină de multe mistere, a căror dezvăluire poate ajuta la înțelegerea unor probleme insolubile ale omenirii.