NOMENCLATURE STEREOCHEMICAL (de la latină la menclatura - listă, listă), este destinată desemnării spațiilor. constructii chimice. compuși. Principiul general al lui N. s. (Regulile IUPAC, secțiunea E) este că spațiile. structura compusului. sunt notate cu prefixele adăugate la nume. fără a schimba aceste nume. și numerotarea acestora (deși uneori caracteristicile stereochimice pot determina alegerea între posibilele metode alternative de numerotare și alegerea circuitului principal).
În inima majorității stereochimilor. desemnările reprezintă regula succesivă, care stabilește în mod unic vechimea deputaților. Mai vechi sunt considerate cele la ryh tratate chiral (vezi. Chiralitate-ness) elementului (ex. Atom ciclu legătură asimetrica. Dublu) este atom conectat direct de numărul atomic mare (vezi. Tabel.). Dacă acești atomi sunt aceeași ordine de vechime, este considerat un „al doilea strat“ din atomii sunt legați la-ing atomi „primul strat“, etc. înainte de apariția primei diferențe; numărul de atomi legați de o dublă legătură, atunci când se determină precedența, este dublat. Naib. o abordare generală a desemnării configurației enantiomerilor este utilizarea sistemului R, S. Simbolul R (lat. Rectus-dreapta) este unul dintre enantiomeri într-un rom privit din modelul opus substituent Jr. alți substituenți precedență cade în sens orar. Fall vechime corespunde acelor de ceasornic cu -oboznacheniyu S (de la Lat. Sinister-stânga) (Fig. 1).
Creșterea vechimii substituenților la un centru chiral:

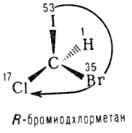
Fig. 1. Schema de determinare a priorității substituenților în compușii organici.
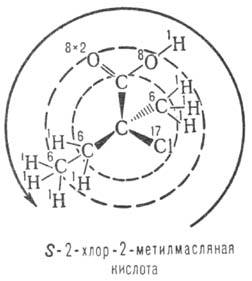
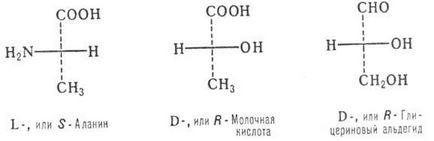
Pentru carbohidrații, se utilizează, de asemenea, acizii a-hidroxi, a-aminoacizii, un sistem D, L bazat pe o comparație a configurației asimetrice în cauză. centru cu configurația enantiomerului corespunzător al aldehidei glicerolice. Când se ia în considerare formulele de proiecție Fisher, aranjarea grupărilor OH sau NH2 din stânga este marcată de simbolul L (de la latin laevus-stânga), pe simbolul D (de la dexterul lat):
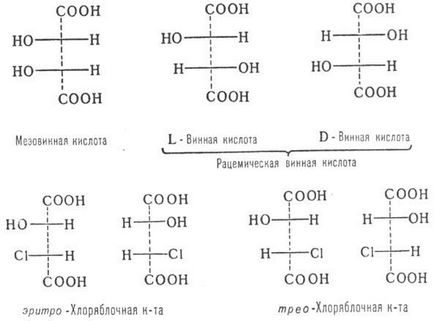
S-diastereomerii (diastereomerii clasici) în cele mai simple cazuri sunt desemnați ca forme mezo- și racemice ale formelor eritro- sau threo-formate:
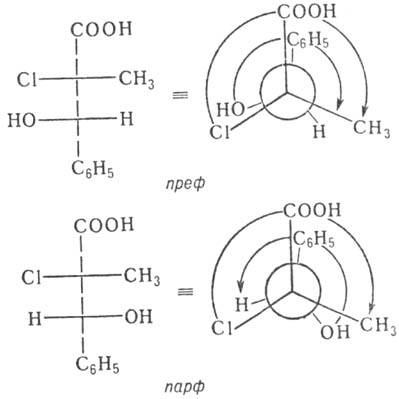
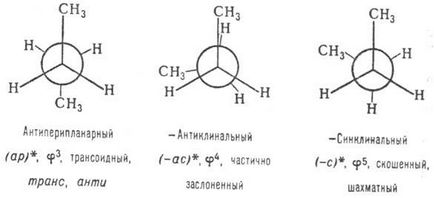
Pentru structurile complexe, când toți cei șase substituenți ai celor doi sunt asimetrici. centrele sunt diferite, se propun alte sisteme. De exemplu. shi, Parfait (pref, rarf) -oboznacheniya bazată pe luarea în considerare a ordinii de prioritate a incidenței (regula secvenței) în formulele Newman: incidența -pref aceeași direcție (prioritate Engl reflectiv.), la -parf opus (Engl prioritate antireflex.). Ex.:
Pentru descrierea spațiilor. structura conexiunii. cu C legătură = C, ciclic și, în cazuri excluzând discrepanțele folosesc denumiri cis și trans (substituenți identici sau înrudite sunt aranjate resp. pe una și pe laturile opuse ale planului legăturii duble sau ciclu), de exemplu. cis-2-butenă (formula I), trans-ciclobutan-1,2-dicarboxilic-ta (II).
Astfel de denumiri devin ambigue pentru alchene cum ar fi abC = Cde, oxime, azometine. În aceste cazuri, se utilizează nomenclatura Z, E (se găsesc substituenții de rang superior ai dublei legături). unul (Z, zusammen - împreună) și diferite (E, de la el entgegen-opus) partea de planul de dublă legătură], de exemplu. (Z) -2-cloro-2-butenă (III), (E, E) -benzildioximă (IV).
În prezența a trei sau mai mulți substituenți în moleculă, aliciclic. sau saturare. geterotsiklich. compușii utilizează nomenclatura r, c, t. Unul dintre deputați este ales pentru "referința" -r (referință, de la referința engleză). Pentru substituenții care se află pe o parte a planului ciclului cu atomul de referință, utilizați notația c (din cis-cuc), pentru substituenții de pe cealaltă parte a planului ciclului -t (de la trans-trans), de exemplu. t-2-c-4-diclor-ciclopentan-M-carbo-compus nou (V).
În seria de steroizi, desemnarea spațiilor. Localizarea substituenților se face pe baza unui dosar plat condiționat.
Substituenții aflați la distanță de observator desemnează a, în apropierea observatorului - b. De exemplu. 11b, 17a, 21-trihidroxi-4-pregnen-3,20-dionă (hidrocortizona, VI).
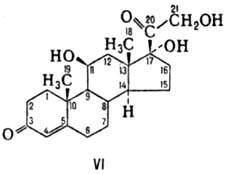
Fig.2. Unghiul dihedral.
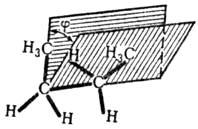
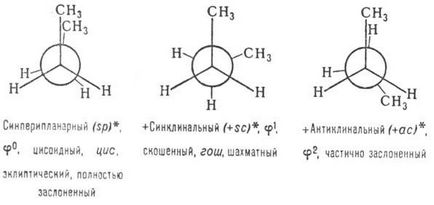
Pentru a identifica conformații ale moleculei indică cantitatea de diedru (diedru) unghiul j între doi substituenți superiori la C-C (fig. 2) la-ing în sens orar numărate și exprimate în unități arbitrare (o unitate este egală cu 60 °), sau de a folosi un verbal localizarea substitutului senior în fișierele lui Newman (figura 3).
===
App. literatură pentru articolul "STEREOCHIMICĂ NOMENCLATURĂ": Normele de nomenclatură ale IUPAC în chimie, vol. 3, Polutom 2, M. 1983, p. 5-118; Nogradi M. Stereochimie. Concepte și aplicații de bază, trans. cu engleza. M. 1984. V. M. Potapov, M.A. Fedorov.
Pagina "STEREOCHIMICĂ NOMENCLATURĂ" este pregătită pe baza materialelor din enciclopedia chimică.