Metale și sudare
Forțele de atracție ale lui Coulomb care rezultă din interacțiunea ionilor încărcați sunt puternice și acționează în mod egal în toate direcțiile. Ca rezultat, dispunerea ionilor este ordonată în spațiu într-o manieră definită, formând o latură de cristal ionic. Substanțele cu Raman ionic în condiții normale sunt în stare cristalină, au puncte de topire și puncte de fierbere ridicate.
Metalele și aliajele lor cristalizează sub formă de laturi metalice. Nodurile din rețeaua metalică sunt ocupate de ioni metalici pozitivi. electronii valenta separați de atomii de metal și nodurile rămase în ionii de cristal cu zăbrele, mai mult sau mai puțin liber în spațiul dintre cationii și determină conductivitatea electrică a metalelor. Interacțiunile electrostatice apar între ioni și electroni liberi, care sunt cauza formării unei legături metalice.
Liantul metalic are o similaritate cu atât ionic (format datorită interacțiunii dintre particule încărcate: electroni și ioni) și covalente (are loc socializarea de electroni, dar spre deosebire de legătură covalentă, unde electronii sunt localizate în jurul determinate ?? atomi ennyh, electronii din metale colectivizat pentru toate cristalele sale). Electronii liberi sunt denumiți uneori gaz de electroni. Cationii din rețelele metalice nu au mișcare de translație, ci oscilează în jurul poziției zonelor de zăbrele. Amplitudinea acestor oscilații crește odată cu creșterea temperaturii și când temperatura de topire a metalului este atinsă, grâul se prăbușește. Punctul de topire al metalelor, ca regulă, crește odată cu creșterea numărului de electroni de valență în atomii lor.
Amestecurile a două sau mai multe metale individuale sunt numite aliaje. În aliaje, unele nemetale (carbon, sulf, siliciu) pot fi de asemenea prezente în cantități mici. O metodă obișnuită de obținere a aliajelor este aceea de a-și încălzi componentele constitutive până când amestecul este topit complet. Cu toate acestea, unele metale nu fuzioneaza intre ele in nici o relatie. aliaje metalice pot fi clasificate după cum urmează: soluții solide interstițiale (Partea cavitati interstițiale ocupate atomi zabrele alt elementa͵, de exemplu, un carbon des ?? EZE-fonta si otel); soluții solide de substituție (o parte a atomilor substanței de bază este înlocuită cu atomi ai elementului de impurități - lipit de staniu - 64 părți de staniu și 36 de plumb); amestecuri de cristale individuale de metale; amestecuri de cristale de compuși intermetalici (metalele topite formează compuși chimici - în cupru există un compus Cu3 Sn)
Forțele Van der Waals sunt forțele interacțiunii intermoleculare (și interatomice) cu o energie de 10-20 kJ / mol. Acest termen a desemnat inițial toate aceste forțe, în știința modernă se aplică, de obicei, forțelor care apar în timpul polarizării moleculelor și formării dipolilor. Sunt deschis. D. van der Waals în 1869.
Forțele Van der Waals ale interacțiunii interatomice a gazelor anorganice determină posibilitatea existenței stărilor agregate de gaze anorganice (gaze, lichide și corpuri solide).
Forțele van der Waals includ interacțiunile dintre dipoli (constante și induse). Numele se datorează faptului că aceste forțe sunt cauza corecției pentru presiunea internă în ecuația de stare a gazului real Van der Waals. Aceste interacțiuni, precum și legăturile de hidrogen determină formarea structurii spațiale a macromoleculelor biologice.
Forțele Van der Waals apar, de asemenea, între o particulă (particule macroscopice sau nanoparticule) și o moleculă și între două particule
15. Metoda de legături de valență. Ideea de hibridizare a orbitalilor atomici. Geometria moleculelor poliatomice: modelul Gillespie.
Metoda legătură de valență (MFR) este numit altfel teoria perechilor de electroni localizate, ca în metoda bazată pe presupunerea că legătura chimică dintre doi atomi se realizează prin una sau mai multe perechi de electroni, care sunt localizate predominant între ele. Spre deosebire de OMI, care este pur și simplu o legătură chimică trebuie să fie de două sau mai multe centre, în MBC este ?? în totalitate sigur când vei doi electroni și două centre. Numărul de legături chimice elementare care pot forma un atom sau ion este egal cu valența sa. La fel ca în IMO, electronii de valență participă la formarea unei legături chimice. Funcția de undă care descrie starea electronilor care formează legătura este denumită în mod obișnuit orbitalul (LO) localizat.
Rețineți că electronii sunt descrise de către LR, în conformitate cu principiul de excluziune ar fi îndreptate în sens opus înapoi, adică în MVS Soare ?? rotiri e sunt asociate, și toate moleculele ?? e trebuie sa fie diamagnetice. Prin urmare, MFR nu poate explica în principiu proprietățile magnetice ale moleculelor.
Cu toate acestea, principiul legăturilor localizate are o serie de avantaje importante, dintre care una este vizibilitatea sa extremă. MVS destul de bine, de exemplu, prezice posibilitățile de valență ale atomilor și geometria moleculei care se formează. Ultima circumstanță este asociată cu așa-numita hibridizare a AO. A fost introdus pentru a explica faptul că legăturile chimice cu două nuclee cu două nuclee formate de AO în diferite stări de energie au aceeași energie. Astfel, Be * (2s 1p 1 1), B * (2s 2p 2 1), C * (2s 2p 1, 3) formează datorită s - și p orbitali, respectiv, două, trei sau patru obligațiuni, și, prin urmare, una dintre ele ar trebui să fie mai puternice decât altele. În acest caz, experiența arată că în BeH2. BCI3. CH4 toate conexiunile sunt echivalente. BeH2 are un unghi de cuplare de 180 °, BCl3 are 120 ° și în CH4, 109 ° 28 '.
orbitali hibrid (GO), care reprezintă sebyalin ?? eynuyu AO combinație de atom - Conform conceptului de hibridizare, legături chimice sunt formate mixte (e - și p AOS Be, B, C), au aceeași energie și forma determinată ?? orientare în spațiu (simetrie). Astfel, s- și p-orbitalul dau două sp-DO, situate la un unghi de 180 ° unul față de celălalt.
Hybrid orbital și geometria moleculelor
Modelul Gillespie se bazează pe ipoteza că cuplarea se datorează unei perechi de electroni, iar structura geometrică a moleculelor / ionilor este determinată de numărul total de perechi de electroni care înconjoară atomul central. Sunt îndeplinite următoarele reguli:
· Perechile electronice, divizate și nedivizate, sunt situate în jurul atomului central astfel încât repulsia lor să fie minimă, ᴛ.ᴇ. la distanța cea mai îndepărtată una de cealaltă
· Perechea de electroni nedorită ocupă un volum mai mare decât perechea electronilor împărțiți
· Volumul ocupat de perechea de electroni care leagă este mai mic decât electronegativitatea atomului asociat centrului
· Două perechi de electroni cu o legătură dublă ocupă un volum mai mare decât o pereche de legături simple
Dezavantaje ale modelului Gillespie
· Inaplicabilitate la cele mai multe conexiuni ale d-, s-elementelor
· Inaplicabilitate la compuși cu o fracțiune semnificativă a ionicității legăturii
· Imposibilitatea de a prezice geometria moleculelor / ionilor cu o pereche electronică incompletă in-house
16. Metodă de orbitale moleculare. Concepte de bază. Două centrale orbitale moleculare cu două electroni. Diagrame energetice ale moleculelor diatomice homonucleare formate din elemente din perioadele 1 și 2. Proprietăți magnetice. Corelații între ordinea legăturii și energia ionizării. Diagrame energetice ale celor mai simple molecule heteronucleare (CO, HF, LiH, H20).
În metoda MO, se presupune că într-o moleculă, ca într-un atom, se pot construi un set de nivele discrete de energie rezolvate și funcțiile de undă corespunzătoare (orbitale moleculare) care descriu comportamentul unui electron într-o moleculă. La fiecare nivel de energie, nu pot fi localizați mai mult de doi electroni. orbitali atomici sunt adesea folosite pentru construirea de funcții MO val (AO), care descrie modul în care fiecare MO yi ling ?? combinație eynuyu AB (MO LCAO).
Alegerea acestei reprezentări MO este destul de ușor de înțeles din punct de vedere fizic: în apropierea fiecărui nucleu dintr-o moleculă, comportamentul unui electron ar trebui să fie similar cu comportamentul său la un atom și descris de atomul AO corespunzător. În acest caz, soluția aproximativă (deoarece pentru molecule ecuația Schrödinger trebuie rezolvată doar aproximativ!), Cel puțin în aceste regiuni va fi suficient de corectă. În regiunea dintre nuclee, MO va fi descrisă printr-o suprapunere de AO. Problema găsirii funcțiilor de undă a MO în acest caz reduce la găsirea coeficienților. În același timp, este extrem de important pentru fiecare Ministerul Muncii să determine energia corespunzătoare.
17. Molecule de hidrogen și metode de descriere a acesteia. Metoda legăturilor de valență și metoda orbitalilor moleculari. Aproximarea LCAO. Suprapunerea orbitalilor atomici, a legăturilor sigma și pi, ordinea (multiplicitatea) conexiunii. Conectarea chimică în particulele H2. H2 - și H2 + din poziția metodelor MO și VS.
18. Legarea chimică în moleculele diatomice homonucleare ale elementelor celei de a doua perioade din poziția metodelor MO și BC. Schemele MO pentru moleculele de la începutul și sfârșitul celei de-a doua perioade. Modificarea ordinii legăturii, a energiei de legare și a lungimii legăturii în tranziția de la Li2 la Ne2. Caracteristicile moleculelor B2 și O2. Rezistența legăturii în molecula N2
19. Molecule diatomice heteronucleare ale elementelor din a doua perioadă. Schemele MO pentru HF, CO, CN, OF. Metoda BC și hibridizarea orbitalilor. Starea de valență a unui atom. Tipuri de hibridizare și structura spațială a moleculelor de către Gillespie.
20. Legătura covalentă în moleculele poliatomice. Interacțiunea donator-acceptor. Comunicare localizată și delocalizată. Conexiuni tri-centrate. Directivitatea și saturația legăturii chimice chimice. Teoria repulsiei perechilor de electroni ale cochiliei de valență și a structurii spațiale a moleculelor
Interacțiunea donator-acceptor - transfer de sarcină între molecule donor și acceptor fără formarea unei legături chimice între ele (mecanism de schimb); sau transferul perechii de electroni de la donator la acceptor, conducând la formarea unei legături (mecanism donor-acceptor).
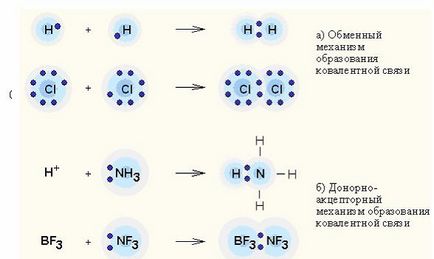
Legarea covalentă este cel mai general tip de legătură chimică care rezultă din socializarea unei perechi electronice printr-un mecanism de schimb. Când fiecare dintre atomii interacțiunii livrează un electron sau un mecanism donor-acceptor. în cazul în care o pereche de electroni este transferată la utilizarea obișnuită a unui atom (donor) la un alt atom (acceptor).
Comunicarea delocalizată este o legătură a cărei pereche de electroni este dispersată între mai multe (mai mult de 2) nuclee de atomi (asemănarea unei legături metalice).
Legătura covalentă trebuie localizată și delocalizată. Localizat este o legătură a cărei electroni sunt de fapt împărțiți între cele două nuclee ale atomilor care sunt legați. În cazul în care electronii de cuplare sunt împărțiți în mai mult de două nuclee, atunci vorbiți despre o conexiune delocalizată.
Legătura delocalizată este o legătură covalentă, a cărei orbită moleculară acoperă mai mult de doi atomi.
În majoritatea cazurilor, obligațiunile delocalizate sunt legăturile π. Caracteristica sistemelor conjugate. În aceste sisteme se realizează o formă specială de influență reciprocă a conjugării atomilor.
Conjugare (meso, din mesos greacă -. Mean) - această aliniere legăturilor și tarifelor în molecula reală (particule), în comparație cu un ideal, dar nici o structură existentă.
Participarea la conjugare delocalizat p orbitali poate să aparțină la două sau tt legături și mai mult sau π conexiune și un atom cu p orbital. În concordanță cu aceasta, π, π-conjugarea și # 961 ;, π-conjugare. Sistemul de cuplare trebuie să fie deschis sau închis și să conțină nu numai atomi de carbon, ci și heteroatomi.
Legătura cu trei centri cu două electroni este una dintre posibilele legături cu deficit de electroni. Caracterizat prin aceea că o pereche de electroni de valență localizate în spațiul imediat trei atomi (de aici term''elektrono-defitsitnosti „“ - „“ normalnym „“ caz este în două centre de legătură doi electroni). Descrierea generală a mecanismului de legături de electroni este dat în termenii teoriei orbitalilor moleculare ( „“ Orbitali model''nesvyazyvayuschih).
Cea mai mare contribuție la dezvoltarea teoriei trohtsentrovyh legături cu două electroni a fost realizat în studiul borohidrurilor și organoboron conectate eny ?? unde legarea astfel este pusă în aplicare foarte des (de exemplu, diboran).
Sunt posibile și alte legături cu deficiență de electroni, cu un raport diferit de electroni de valență la atomii legați. O astfel de legare este adesea realizată în compuși organometalici.
VSEPR orbitali teoria valență (OEPVO) - una dintre abordările în chimie necesare pentru a explica și prezice geometriimolekul. Conform acestei teorii molecula în întregime ?? când vei va lua forma, în care perechea de electroni externă repulsie este minimă (principiul minim de energie).
Proprietățile caracteristice ale legăturii covalente - directivitatea, saturația, polaritatea, polarizabilitatea - determină proprietățile chimice și fizice ale compușilor.
Direcția legăturii se datorează structurii moleculare a substanței și formei geometrice a moleculei. Unghiurile dintre două legături se numesc legături de valență.
Saturația este capacitatea atomilor de a forma un număr limitat de legături covalente. Numărul de legături formate de un atom este limitat de numărul orbaliilor atomici externi.
Polaritatea cuplării se datorează distribuției inegale a densității electronilor datorită diferențelor în electronegativitatea atomilor. Pe această bază legături covalente subdivizat în nepolar și polar (nepolare - molecula diatomica este format din aceiași atomi (H2 Cl2 N2) și norii de electroni din fiecare atom sunt distribuite simetric în raport cu acești atomi .. Polar - molecula diatomica este format din atomi de diferite elemente chimice, și totalul nor de electroni se mișcă spre unul dintre atomii, formând astfel o partiționat ?? Eniya asimetrie a sarcinii electrice în moleculă, generând momentul de dipol al moleculei).
Polarizabilitatea legăturii se exprimă prin deplasarea electronilor legați sub influența unui câmp electric extern, și o altă particulă reactivă. Polarizabilitatea este determinată de mobilitatea electronilor. Polaritatea și polarizabilitatea legăturilor covalente determină reactivitatea moleculelor în raport cu reactivii polari.
21. Legarea chimică și tipurile de cristale. Tipuri de laturi cristaline. Bazele teoriei bandelor. Conectarea în metale, semiconductori și dielectrice. Defecte ale rețelei de cristal. Soluții solide. Legarea ionică. Interacțiunea ionilor în rețeaua de cristal. Energia reticulului cristalin ionic, efectul dimensiunilor și încărcărilor de ioni
Teoria benzii, descrierea mișcării electronilor în cristale, este baza teoriei moderne a metalelor, a semiconductorilor și a dielectricilor.
Mărimea decalajului de bandă este o valoare cheie și determină proprietățile electrice și optice ale materialului.
Conductorii sunt materiale din care zona de conductivitate și zona de suprapunere a valenței formează o zonă - banda de conducție (astfel electronul se poate deplasa liber între ele).
Dielectricile sunt materiale din care zona nu se suprapune. Pentru a transfera un electron din banda de valență în banda de conducție, este necesară o energie considerabilă, astfel încât dielectricii să nu producă aproape nici un curent.
Semiconductorii sunt materiale din care zonele nu se suprapun. Pentru a transfera un electron din banda de valență în banda de conducție, este necesară o energie mai mică decât pentru un dielectric, astfel încât semiconductoarele pure să treacă prost de curent.
· Moleculare - moleculele sunt localizate la nodurile rețelei moleculare, această latură este inerentă într-un compus cu o legătură covalentă. aici nu sunt metalele, (excepțiile H, Si) - Toți compușii organici H2SO4-HCI
Atomic - în noduri sunt atomi diamant, grafit - nu se dizolvă în apa de refractar. în general nu este solubil
· Ionic - în noduri există ioni pozitivi, negativi, care sunt conectați unul cu altul prin atracția electrică a sarei. baze, baze. Rezistență, punct de topire ridicat. nu volatile. multe sunt solubile în apă
· Metal - în noduri se află atomi de metal, căldură conductivă
Citiți de asemenea
Forțele de atracție ale lui Coulomb care rezultă din interacțiunea ionilor încărcați sunt puternici și acționează în mod egal în toate direcțiile. Ca rezultat, aranjamentul ionilor este comandat în spațiu într-un anumit mod, formând o latură de cristal ionic. [citeste mai mult].