1. Cum sunt localizați electronii la nivelurile de energie și subsolurile într-un atom de carbon? De ce în atomul de carbon este posibilă asocierea electronilor 2s și care este forma lor de nori de electroni?
Structura învelișului electron al atomului de carbon este 1s22s22p2. Atomul de carbon are 4 electroni de valență, dintre care numai 2 electroni nepartiți se află pe orbite 2p.
pe cea de-a doua coajă de electroni există încă o orbită 2p liberă pe care poate trece unul dintre electronii cu orbitalii 2s. În același timp, atomul de carbon are patru electroni nepartiți:
Astfel, atomul de carbon 4 pot forma legături covalente, în care hibridizarea are loc orbitali: 4 orbitali identice sunt formate, fiecare dintre acestea având forma unui opt alungit direcționat către vârfurile tetraedru.
2. Desenați formule electronice de metan și etan. Explicați cum se formează legăturile chimice în moleculele acestor substanțe atunci când se suprapun norii de electroni corespunzători.
Formule electronice de metan și etan:
metan
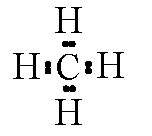
In molecula de metan este format din patru legături chimice atunci când se suprapun patru orbitali hibrizi de SP3 atomi de carbon de la 1 s-orbitali ale celor patru atomi de hidrogen.
În molecula de etan, legătura dintre atomii de carbon este formată prin suprapunerea spri-orbitalilor hibrid sp3 ai doi atomi de carbon. Fiecare atom are încă trei orbite hibride și când aceste orbite se suprapun cu orbitele 1 s de șase atomi de hidrogen, se formează șase legături C-H.
3. Sa dovedit experimental că metanul are o formă tetraedrică de structură moleculară. Cum explică acest fapt experimental doctrina formelor de nori de electroni și hibridizarea lor?
Când se hibridizează norii electronici într-un atom de carbon de la o s-orbitală și trei p-orbite, se formează patru spi-orbite hibride identice. Vasele orbite hibride sunt direcționate către vârfurile tetraedrului, iar când se formează legături covalente, aceste legături se confruntă de asemenea cu vârfurile tetraedrului. Prin urmare, molecula de metan are o formă tetraedrică.
4. Ce compuși se numesc hidrocarburi marginale? Dați exemple.
Limita este definită ca hidrocarburi cu formula generală c2n2n + 2. exemple: metan CH4, etan C2H6, hexan C6H14.
5. Alcan, a cărui moleculă conține șapte atomi de carbon, are formula:
A. C7H16
6. Numai formulele de alcani sunt scrise în serie:
2) C2H6, C3H8, C4H10
7. Ce substanțe se numesc omologi? Dați exemple
Homologii sunt compuși organici care diferă unul de altul în una sau mai multe grupări - CH2. Homologii sunt alcani: metan, etan, propan etc.
8. Scrieți formule și denumiri ale radicalilor care pot fi derivați din primele șase hidrocarburi marginale.
metil
9. Compuneți formule structurale prescurtate și semnați numele tuturor izomerilor posibili ai hexanului.
hexan
10. Dați numele hidrocarburilor finale, care au următoarele formule:
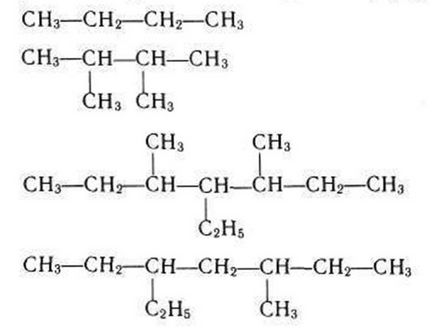
a) butan
b) 2,3-dimetilbutan
c) 3,5-dimetil-4-etilheptan
d) 3-metil-5-etilheptan
11. Desenați formula structurală a 2,2,4-trimetilpentanului
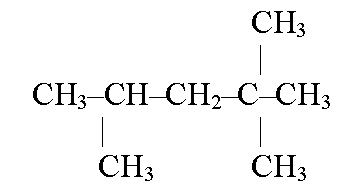
12. Unde și sub ce formă se produc hidrocarburi terminale în natură?
Metanul - partea principală a gazului natural, se formează și în timpul descompunerii reziduurilor de plante. Et al. alcani fac parte, de asemenea, din gaze naturale, hidrocarburi cu un număr mare de atomi de carbon fac parte din petrol.
13. Când acetatul de sodiu este încălzit cu hidroxid de sodiu, se formează:
2) metan
14. Reacția clorometanului cu sodiu produce:
2) etan
15. Alcanii se caracterizează prin reacții:
2) substituție
16. Cum se poate distinge metanul de hidrogen prin experimentare?
La arderea metanului se formează în plus față de apă CO2:
dacă gazul produs prin arderea metanului este trecut prin apa de var, se depune un precipitat:
17. În ce condiții are loc dehidrogenarea etanului? Scrieți ecuația de reacție:
Dehidrogenarea etanului are loc atunci când este încălzită în prezența unui catalizator, cu formarea de etilen:
18. Cu privire la exemplul de cloretan pe baza conceptelor moderne, deschideți esența influenței reciproce a atomilor în moleculă.
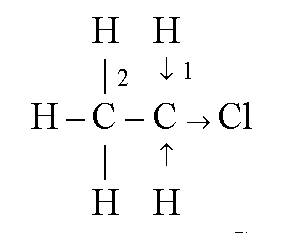
În molecula de cloretan, densitatea electronică este transferată la clor. Datorită distribuției inegale a densității electronice, există o diferență de potențial, care afectează proprietățile fizico-chimice ale moleculei. Ea devine polară. De exemplu, cloretanul, spre deosebire de etan, este solubil în alcooli și eteri.
19. În industria cărbunelui și a metanului primesc așa-numitul gaz de sinteză? Scrieți ecuațiile pentru reacțiile chimice corespunzătoare.
20. Scrieți ecuațiile reacțiilor prin intermediul cărora se pot realiza următoarele transformări:
1.
2. Se formează clorometan în lumină:
(nota În loc de = pune →)
21. Faceți un rezumat al răspunsului care caracterizează metanul și etanul completând tabelul.


