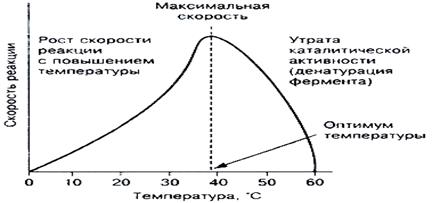
Creșterea temperaturii activității enzimei crește. O creștere suplimentară a temperaturii agravează posibilitățile catalitice ale enzimei, începe denaturarea termică a enzimei. Prin urmare, dependența v (T) are, cu o scădere bruscă a activității la temperaturi ridicate în formă de clopot. Stabilitatea termică pentru diferite enzime este diferită. Pentru instabilitatea termică sunt. de exemplu, kinază care își pierd activitatea la 43 ° C. Există enzime stabile până la 100 ° C caracteristică O astfel de stabilitate a polimerazei ADN-ului bacterian este utilizat pentru a diagnostica ADN (reacție în lanț a polimerazei, PCR).
Dependența ratei de reacție enzimatică la pH:
pH-ul caracterizează aciditatea mediului. Cu cât pH-ul este mai mic, cu atât mediul este mai acid.
Când protonarea proteinelor modifică structura sa spațială și activitatea enzimatică. Majoritatea enzimelor au o activitate optimă la pH apropiat de 7 (mediu neutru). Cu toate acestea, după cum se poate vedea în figură, optimul de pepsină se află într-un mediu acid
2) și optimul fosfatazei alcaline într-un mediu alcalin (pH
Când acidul este adăugat la enzimă, un număr de aminoacizi sunt protonați. Acest lucru poate duce la o schimbare a structurii spațiale a enzimei sau la schimbări în centrul activ. Există enzime care sunt foarte sensibile la modificările pH-ului, și există acelea care funcționează într-o gamă largă de pH. Imaginați-vă centrul activ al enzimei. Sarcina sa, ajustarea la starea de tranziție a enzimei cât mai mult posibil pentru a reduce energia stadiului de tranziție a substraturilor (energia de activare). Pentru a face acest lucru, în jurul legăturilor care urmează să fie dispuse sunt plasate grupurile electroacceptoare de aminoacizi și unde trebuie să se formeze legături - grupurile de donatori de electroni. Coenzimele participă la enzimele de proteine în cataliză fermentativă. Următoarele abordări sunt tipice pentru cataliza enzimatică:
1. Enzimele leagă în mod specific substraturile din centrul activ. În acest caz, substraturile sunt orientate astfel încât să obțină o poziție optimă pentru formarea unei stări de tranziție.
2. În plus, stratul de hidrat al substratului este îndepărtat. Ca urmare, sunt create condiții complet diferite decât în soluție.
3. Datorită interacțiunii dintre reziduurile de aminoacizi ale proteinei și substratului, complexul de tranziție ES se stabilizează.
4. Deseori efectuat transferul de protoni. Aceasta este o cataliză enzimatică bazică acidă.
5. Deseori, grupurile chimice se atașează covalent la resturile enzimei. Acest fenomen se numește cataliză covalentă.
6. Interacțiunea cu radicalii de aminoacizi determină deformarea substratului (cataliza deformării), care facilitează procesul.