Greutatea moleculară este determinată prin diferite metode: osmometric, filtrare pe gel, optică etc. Cu toate acestea, cea mai precisă este metoda de sedimentare propusă de T. Svedberg. Se bazează pe faptul că atunci când ultracentrifugarea este accelerată la 900.000 g, viteza de precipitare a proteinelor depinde de greutatea lor moleculară.
Cea mai importantă proprietate a proteinelor este capacitatea lor de a se manifesta atât acidă, cât și bazică, adică acționează ca electroliți amfoterici. Acest lucru se datorează diferitelor grupări de disociere care alcătuiesc radicalii de aminoacizi. De exemplu, proprietățile acide ale proteinei se atașează la grupările carboxil ale aminoacizilor glutamici aspartici, iar cei alcalini sunt radicalii argininei, lizinei și histidinei. Mai mulți aminoacizi dicarboxilici sunt prezenți în proteină, cu atât sunt mai puternice proprietățile sale acide și viceversa.
Aceleași grupări au, de asemenea, încărcături electrice care formează o sarcină comună a moleculei de proteine. În proteine, în care predomină aminoacizii aspartici și glutamici, încărcarea proteinei va fi negativă, un exces de aminoacizi bazici conferă o încărcătură pozitivă moleculei de proteine. Ca o consecință, în câmpul electric, proteinele se vor deplasa la catod sau anod, în funcție de valoarea încărcării lor totale. Astfel, într-un mediu alcalin (pH 7-14), proteina renunță la un proton și se încarcă negativ, în timp ce într-un mediu acid (pH 1-7), disocierea grupărilor acide este suprimată și proteina devine un cation.
Astfel, factorul care determină comportamentul proteinei ca un cation sau anion este reacția mediei, care este determinată de concentrația de ioni de hidrogen și este exprimată prin valoarea pH-ului. Totuși, la anumite valori ale pH-ului, numărul de sarcini pozitive și negative este egalizat și molecula devine neutră din punct de vedere electric, adică nu se va mișca în câmpul electric. O astfel de valoare a pH-ului mediului este definită ca punctul izoelectric al proteinelor. În același timp, proteina este în starea cea mai puțin stabilă și cu ușoare modificări ale pH-ului, precipită ușor în partea acidă sau alcalină. Pentru cele mai multe proteine naturale, punctul izoelectric este într-un mediu slab acid (pH 4,8 - 5,4), ceea ce indică predominanța aminoacizilor dicarboxilici în compoziția lor.
Proprietatea amfotericității subliniază proprietățile tampon ale proteinelor și participarea lor la reglarea pH-ului sanguin. Valoarea pH-ului sângelui persoanei este constantă și se situează în intervalul 7.36 - 7.4. în ciuda diferitelor substanțe de natură acidă sau de bază, alimentate regulat cu alimente sau formate în procese metabolice - de aici există mecanisme speciale pentru reglarea echilibrului acido-bazic al mediului intern al corpului. Astfel de sisteme includ cel considerat în Ch. Sistem de "tamponare a hemoglobinei" (p. 28). Modificarea pH-ului sângelui mai mare de 0,07 indică dezvoltarea procesului patologic. Schimbarea pH-ului la partea acidă se numește acidoză și este alcalină în alcaloză.
Esențial pentru organismul are capacitatea adsorbirovat proteinele de pe suprafața lor anumite substanțe și ioni (hormoni, vitamine, fier, cupru), care sunt fie slab solubili în apă sau sunt toxice (bilirubina, acizi grași liberi). Proteinele le transportă prin sânge în locuri de transformare sau neutralizare.
Soluțiile apoase de proteine au propriile caracteristici. În primul rând, proteinele au o mare afinitate pentru apă, adică ele sunt hidrofile. Aceasta inseamna ca moleculele de proteine, cum ar fi particulele incarcate, deseneaza dipoli de apa la ei insisi, care sunt localizati in jurul moleculei de proteine si formeaza o carapa apoasa sau hidratata. Această membrană protejează moleculele de proteine de lipire și precipitare. Dimensiunea carcasei hidratate depinde de structura proteinei. De exemplu, albuminele se leagă mai ușor de moleculele de apă și au un înveliș apos relativ mare, în timp ce globulinele, fibrinogenul atrag apa mai rău și coaja hidratată este mai mică. Astfel, stabilitatea soluției apoase de proteină este determinată de doi factori: prezența unei încărcări a moleculei de proteină și a învelișului de apă din jur în jurul acesteia. Când acești factori sunt îndepărtați, proteina precipită. Acest proces poate fi reversibil și ireversibil.
Recipitarea reversibilă a proteinelor (salting-out) implică precipitarea proteinelor în sediment sub acțiunea anumitor substanțe, după îndepărtarea cărora se revine la starea inițială (nativă). Sărare din proteine este utilizat pentru metale alcaline și alcalino-pământoase (cel mai des utilizate în practica de sulfat de sodiu și amoniu). Aceste săruri elimină coaja de apă (provoacă deshidratarea) și elimină încărcarea. Între magnitudinea membranei apoase a moleculelor de proteine și concentrația de săruri există o relație directă: cu cât este mai mică coaja hidratată, cu atât mai puțină sare este necesară. Astfel, globuline având molecule grele și mari și mici cochilie precipitat apos din incompletă soluție de săruri de saturare și albumine ca și moleculele mici înconjurate de coajă de mare de apă, - la saturație maximă.
Molecule de proteine native
O moleculă de proteină denaturată. Picăturile denotă legăturile din molecula proteinei native, care se rupe cu denaturarea

Precipitarea ireversibilă este asociată cu schimbări intramoleculare profunde în structura proteinei, ceea ce duce la pierderea proprietăților lor native (solubilitate, activitate biologică etc.). O astfel de proteină se numește denaturată, iar procesul este denaturat. Denaturarea proteinelor are loc în stomac, unde există un mediu puternic acid (pH 0,5 - 1,5), ceea ce promovează digestia proteinelor prin enzime proteolitice. Denaturarea proteinelor este baza pentru tratamentul otrăvirii cu metale grele atunci când pacientul este injectat pe bază de lapte sau ouă crude, astfel încât metalele să denatureze proteinele din lapte sau ouă.
Adsorbate pe suprafața lor și nu au acționat pe proteinele membranei mucoase a stomacului și intestinelor și, de asemenea, nu au fost absorbite în sânge.
Dimensiunea moleculelor de proteine se situează între 1 μm și 1 nm și, prin urmare, ele sunt particule coloidale, care formează soluții coloidale în apă. Aceste soluții sunt caracterizate de o înaltă vâscozitate, capacitatea de a împrăștia razele luminoase vizibile, nu trec prin membranele semipermeabile.
Viscozitatea soluției depinde de greutatea moleculară și de concentrația substanței dizolvate. Cu cât greutatea moleculară este mai mare, cu atât soluția este mai vâscoasă. Proteinele ca compuși cu conținut molecular ridicat formează soluții vâscoase. De exemplu, o soluție de albus de ou în apă.
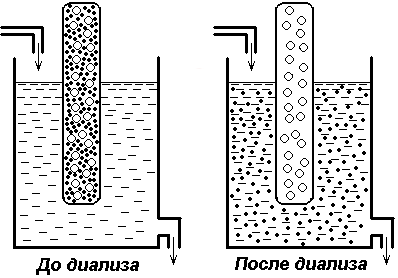
particulele de oloid nu trec prin membranele semipermeabile (celofan, film coloidal), deoarece porii lor sunt mai mici decât particulele coloidale. Toate membranele biologice sunt impermeabile la proteine. Această proprietate a soluțiilor proteice este utilizată pe scară largă în medicină și chimie pentru a purifica preparatele proteice din impurități străine. Acest proces de separare se numește dializă. Fenomenul de dializă se află în centrul aparatului "rinichi artificiali", care este utilizat pe scară largă în medicină pentru a trata insuficiența renală acută.
Dializă (cercuri mari albe - molecule de proteine, negru - molecule de clorură de sodiu)
Substanțe minerale din lapte
Proprietăți structurale și mecanice ale uleiului.
Potrivit lui Rebinder, există două tipuri principale de structuri.
Primul tip - structura de coagulare - este grilele spațiale care apar prin coeziunea nediscriminatorie a celor mai mici particule ale unei faze dispersate sau micromolecule prin straturile subțiri ale unui mediu dat.
Al doilea tip este structura de cristalizare-condensare. formată ca rezultat al interacțiunii directe a cristalelor cu formarea unui solid policristalin.
Bazele grase de margarină se referă la tipul de coagulare a structurilor. Proprietățile de consistență și plastic ale bazelor grase de margarină sunt determinate, în principal, de raportul dintre fazele solide și cele lichide în una sau alta grăsime comestibilă. Acest raport al fazelor solide și lichide este caracteristic pentru anumite condiții specifice de cristalizare (temperatură, timp, amestecare). În același timp, compoziția mediului continuu și a fazei dispersate și caracterul fazei dispersate într-un mediu lichid continuu sunt de o mare importanță.
Pentru unele tipuri de grăsimi comestibile, la o anumite condiții de temperatură și cantitatea de cristalizare a fazei disperse solidă poate depăși limita relației optime de fază și apoi pe suprafața cristalelor formate ca o peliculă subțire continuă a mediului lichid, ele nu pot perturba masa haotică a cristalelor matisate unele cu altele. În acest caz, vom avea întotdeauna cea mai mare duritate de consistență a bazei de grăsime kroshlivuyu și cele mai rele proprietăți de plastic.
Dacă la temperatura camerei filmele unui mediu lichid continuu au grosime optimă, adică cele care nu creează condiții pentru despicare de cristale în timpul depozitării, în timpul impactului mecanice sau termice asupra sistemului, în acest caz ideal, vom primi întotdeauna întărită structura de coagulare, care determină proprietățile cele mai bune plastic pe bază de grăsime.
Pentru a obține structuri de coagulare întărite cu cele mai bune proprietăți plastice, sunt adesea introduse două tipuri de salomas cu punct de topire de 32 ° C și 42 ° C în formularea de bază grasă. În acest caz, se introduce o cantitate destul de semnificativă de uleiuri vegetale lichide. Deasupra pe de o parte, se creează o mai faze solide și lichide pe bază de grăsimi raport pentru a asigura o consistență similară cu unt, iar pe de altă parte, creează condițiile pentru constanța consistența margarinei într-un interval destul de mare de temperaturi. Odata cu aceasta, introducerea de topire înaltă bază de grăsimi salomas este în contradicție cu cerințele fiziologi la compoziția grăsimilor alimentare.
În primul rând, trebuie remarcat faptul că numai prezența unor emulgatori stabilizatori foarte eficienți a permis crearea unei tehnologii moderne în producția de margarină și asigurarea producerii de produse grase comestibile de înaltă calitate. Aditivii activi de suprafață asigură o dispersie fină a emulsiei în legarea puternică a particulelor dintr-o fază dispersată cu un mediu continuu (solid în grăsime la temperatura camerei). Problema principală în producerea de margarină este efectul aditivilor activi de suprafață asupra proprietăților structurale și mecanice ale margarinei și, în special, asupra capacității de solubilizare.
Stratul de adsorbție al emulgatorului sporește stabilitatea emulsiei, în special în cazul în care acest strat este structurat pentru a forma un film de gel de suprafață cu o viscozitate și o rezistență foarte mare.
Aceste proprietăți au o importanță deosebită pentru producerea de margarină, deoarece produsul finit este o emulsie a celor mai fine particule ale fazei lichide situate uniform într-un mediu continuu al fazei solide la temperatura camerei.
Problema rezistenței emulsiilor este strâns legată de tipul de emulsii formate cu acest emulgator. Există două tipuri de formare. Valoarea raportului dintre volumele de fază pentru un anumit tip de emulsie formată se explică prin faptul că coalescența și stratificarea unei emulsii de acest tip apar mai intens, cu atât volumul mediu de dispersie este mai mic și faza dispersată este mai mare. Dacă emulgatorul furnizează o emulsie stabilă de un singur tip, atunci raportul de volum nu mai este decisiv în determinarea tipului de emulsie. Inversiunea depinde nu numai de raportul volumelor de faze, ci și de concentrația și natura chimică a emulgatorului.
Emulsifiantul trebuie să aibă următoarele proprietăți:
- reduce tensiunea superficială;
- adsorbite rapid la interfață, prevenind fuzionarea picăturilor;
- au o structură moleculară specifică cu grupuri polar și nepolar;
- afectează viscozitatea emulsiei.
Eficiența emulsificatorului este o proprietate specifică, în funcție de natura sa, cum ar fi substanțele emulsifiabile, temperatura, pH-ul mediului, concentrația, timpul de emulsionare etc.
Eficacitatea acțiunii și natura emulgatorului determină tipul de emulsie.
emulgatori hidrofili, mai bine solubili în apă decât în hidrocarburi contribuie la formarea de emulsii de ulei - apă și hidrofobe, mai bine solubil în hidrocarburi - emulsii apă - ulei. Raportul dintre mărimea pieselor polare și nepolare ale moleculelor emulgator se caracterizează prin indicele special - HLB. Dacă HLB unui emulgator este 3-6, apă formează emulsie - ulei, cu o valoare HLB de 8-13, de preferință, format emulsie ulei - apă.
Margarina este o emulsie supercoolată a tipului apă-în-ulei. Este posibil ca o emulsie de tip mixt cu predominanța unei emulsii de apă-ulei să fie posibilă.
Funcțiile principale ale emulgatorilor:
- crearea unei emulsii stabile, foarte dispersate;
- stabilizarea și prevenirea separării umidității și grăsimii în produsul finit;
- asigurarea stabilității în timpul depozitării;
- asigurarea capacității anti-pulverizare pentru prăjire;
- asigurarea plasticității;
- asigurarea creării unei forme stabile a laturii cristaline în procesul de formare a structurii;
- menținerea proprietăților funcționale date ale produsului finit în funcție de domeniul de utilizare a margarinei.
În Ucraina, de mulți ani, au fost utilizați emulgatori, produși în Rusia, și producția proprie, produsă în industrii semi-industriale. Acestea includ emulgatori:
- T-1 - un produs de gliceroliză a grăsimilor din carne de vită sau salomasă;
- T-2 - produs de polimerizare a glicerinei, esterificat cu acid stearic;
- T-F - un amestec de emulgator T-1 și concentrat de fosfatide alimentar într-un raport de 2: 1;
- PMD - monogliceride alimentare;
- emulsificator combinat CE - un amestec de PMD și concentrat de fosfatide într-un raport de 3: 1.
O gamă largă de emulgatori ai uzinei Nișni Novgorod - diferite tipuri de monogliceride distilate. În prezent, o serie de noi emulgatori pe bază de lecitină au fost dobândite în Nižni Novgorod. Acestea sunt lecitine standard, lecitine fracționate - fosfaditilcolină și fosfatidilserină, precum și lecitine hidrolizate.
În ultimii ani, în Ucraina, au fost utilizate în cea mai mare parte emulsificatori de diferite modificări ale seriei Dimodan, Palsgaard (în unele întreprinderi Quest).
În perioade diferite, avantajul în cererea pentru aceste două tipuri de emulgatori s-a schimbat de la un la altul. Putem spune că există o concurență de calitate - preț.
În funcție de conținutul de grăsime al margarinei și domeniul său de aplicare utilizare emulgatorii Dimodan PVP (Dimodan HP), Dimodan OT (Dimodan S-T PEL / B), Dimodan superlattice. Pentru un conținut de grăsime margarina sub 40%, ceea ce este în prezent în cerere în populație sunt folosite în continuare (cu excepția Dimodan RT sau CP Dimodan sau Dimodan LS.) Esterii poliglicerici și acid ricinoleic - GRINSTED PGPR90.
Trebuie remarcat faptul că producătorii oferă recomandări privind utilizarea diferitelor tipuri de emulgatori și sisteme de stabilizare, în funcție de scopul margarinelor. Respectarea acestor recomandări vă permite să obțineți produse de înaltă calitate