Ameliorarea cu apă este procesul de reducere a durității apei, adică scăderea concentrației de ioni de calciu și magneziu.
Metode de dedurizare a apei:
· Înmuiere termică a apei
· Înmuiere a apei cu reactivi
Înmuierea termică a apei se bazează pe încălzirea apei, distilarea și înghețarea. Duritatea provizorie a apei, formată din bicarbonat de calciu și magneziu, este complet eliminată prin fierbere timp de o oră. În timpul procesului de fierbere, hidrocarburile solubile trec în carbonați insolubili, care cedează sub formă de precipitat sau scară albă, cu eliberarea dioxidului de carbon. Duritatea apei este aproape complet eliminată prin distilarea termică a apei, deoarece cationii și anionii nu trec în abur.
Refacerea apei în înmuiere. Se folosesc două metode de dedurizare chimică a apei: var și sodă-sodă. Aceste metode de purificare a apei se bazează pe transferul de ioni de Ca2 + și Mg2 + la compuși cu solubilitate redusă: carbonat de calciu CaCO3 și hidroxid de magneziu Mg (OH) 2.
Aplicarea durului de apă (până la aproximativ 0,3 mmol / dm 3) se face prin adăugarea de var, sodă caustică sau sifon (metoda lime-soda):
Dioxidul de carbon dizolvat în apă CO2 reacționează de asemenea cu var hidratat:
Ca agent de înmuiere, se folosește, de asemenea, fosfat de trisodiu Na3P04. eliminând rigiditatea temporară și constantă și permițând o înmuiere mai completă (până la 0,015 mmol / dm 3). Trisodium fosfatul face parte din pulberile moderne de spălare.
Schimbul de ioni. Schimbătorii de ioni și rășinile schimbătoare de ioni au fost utilizate începând cu anii 1960. Rășinile schimbătoare de rășină (sorbenți - schimbători de ioni) sunt substanțe solide, insolubile, sub formă de sfere fin dispersate. Aceste rășini se bazează pe o matrice sintetică (schelet) care conține o încărcătură pozitivă sau negativă și un contraion care compensează sarcina matricei. Purificarea apei se produce ca urmare a schimbului de elemente (infectate pozitiv sau negativ) ale matricei de rășină schimbătoare de ioni în elemente de impurități dizolvate în apă. Astfel, concentrația de contaminanți dizolvați scade semnificativ. Ulterior, în timpul regenerării sistemelor de tratare a apei, poluarea acumulată din apă este evacuată în drenaj.
La un exces mic de duritate a apei și a unui reziduu uscat în apă, se utilizează rășină cu cation de sodiu. Când apa tare trece prin rășina schimbătoare de cationi, cationii de Ca 2+ și Mg 2+ fac schimb de cationi Na +. sunt incluși în compoziția de rășină, astfel, cationii Ca2 + și Mg 2+ rămân pe rășină și Na + cationi intra în dedurizarea apei. În cele din urmă, toate cationii Na + Cationii sunt schimbate pentru rigidizarea rășină schimbătoare de cationi își pierde capacitatea de a se înmoaie apă și trebuie regenerat. În acest scop, rășina este spălată cu soluție salină NaCl, rezultând într-un proces invers de emoliere cationi de sodiu sunt transferate în compoziția de rășină, astfel, deplasarea cationii de calciu și magneziu în apa de spălare, se toarnă în scurgere (canalizare). După aceea, rășina îmbogățită cu sodiu devine din nou pregătită pentru înmuiere.
Pentru desalinizarea completă (deionizarea) a apei după filtrul de cationi trece prin anionit. Ca schimbători de anioni, se utilizează rășinile obținute ca urmare a reacției dintre amine și formaldehidă sau polietilenă poliamină cu epiclorhidrină.
Amestecarea boabelor de schimbător de cationi și anioniți, este posibil să se extragă simultan cationi și anioni din apă.
Metode de purificare a apei - filtrare prin membrane speciale. În funcție de dimensiunea porilor membranei distinge microfiltrare, ultrafiltrare și nanofiltrare. Microfiltrarea permite separarea impurităților mai mari de 0,1 μm; Se utilizează în medicină, industria alimentară la întreprinderile producătoare de băuturi alcoolice și nealcoolice, pentru purificarea apei în sistemele de tratare a apei. membrane de ultrafiltrare având o dimensiune a porilor de la 20 la 1000 A (sau 0,002-0,1 mm) și permite amenda întârziere și impurități coloidale, macromolecule (limita inferioară a greutății moleculare de câteva mii), alge, microorganisme unicelulare, chisturi, bacterii și virusuri, etc. .D. Nanofiltrare este utilizat pentru obținerea apei ultrapure liber de bacterii, virusuri, microorganisme, particulele coloidale de compuși organici (inclusiv pesticide), moleculele de săruri de metale grele, nitrați, nitriți și alți contaminanți.
Osmos invers. Aceste instalații și metodele de purificare a apei au început să fie utilizate în 1960. Osmoza este o tranziție spontană a materiei printr-o membrană semipermeabilă care separă două soluții cu concentrații diferite sau o soluție și un solvent pur. În general, substanța dizolvată dintr-o soluție cu o concentrație ridicată încearcă să treacă într-o soluție cu o concentrație scăzută. Dacă presiunea într-o soluție cu o concentrație scăzută este crescută, fluxul substanței dizolvate va înceta. Diferența de presiune, care oprește fluxul de materie (filtrare) prin membrană, se numește presiune osmotică. Fenomenele osmotice sunt extrem de comune în lumea plantelor și a animalelor. Osmoza asigură penetrarea substanțelor nutritive în celulă și eliberarea în mediul intercelular a produselor de activitate vitală. Osmosul inversat este o metodă de separare a soluțiilor în care apa purificată este furnizată la o presiune de 3-8 MPa la o membrană semipermeabilă, în timp ce apa este filtrată prin pori și substanța dizolvată rămâne.
Apa care a fost purificată prin osmoză inversă sau nanofiltrare în proprietățile sale este foarte aproape de apa dezghetată a ghețarilor vechi, care este considerată a fi cea mai curată.
Determinați rigiditatea carbonatului, non-carbonatului și magneziului. Pe baza acestor date, cantitatea de var și sifon necesar pentru a elimina rigiditatea se ia în calcul.
Duritatea apei totală (cantitatea totală de ioni de calciu și magneziu), pot fi determinate prin complexonometrice - titrare soluție Trilon B în prezența indicatorilor cromogene complexonometrice indicator - albastru sau negru în mediu amoniacal (pH 9 - 10). Această metodă se bazează pe faptul că ionii de calciu și magneziu sunt legați de compușii complexați de Trilon B. Se efectuează următoarea reacție (pe exemplul de Ca2 +):
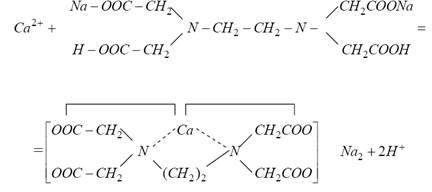
Metalul înlocuiește ionii de hidrogen ai grupărilor carboxil și este legat simultan prin coordonarea cu atomii de azot. Indiferent de încărcarea cationului în reacția de complexare, un anion de EDTA și un cation metalic participă, cu eliberarea a doi ioni de hidrogen. Sfârșitul reacției este evaluat printr-o schimbare a culorii indicatorului metalic [1] al negrului T erocromic de la roșu la albastru-gri. Apariția unei colorări albastru-gri indică absența ionilor de Ca2 + și Mg2 + în soluție, adică despre legarea completă a trilogiei lor B.