Formarea structurii primare a hormonilor de proteine sau prohormonii-peptide inițial - un rezultat direct al traducerii secvențelor de nucleotide ale ARNm-ului respectiv sintetizat pe regiunile active ale genomului celulelor producatoare de hormoni. Structura majorității hormonilor proteici sau a precursorilor acestora se formează în polizomi în conformitate cu schema generală a biosintezei proteinelor (Figura 26).
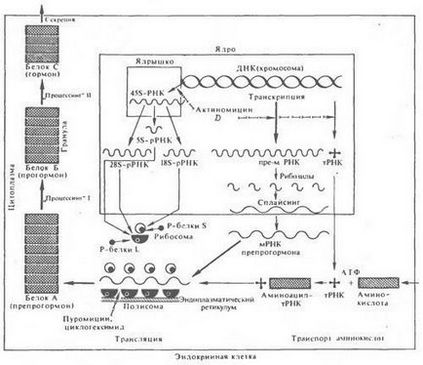
Fig. 26. Sinteza unei proteine într-o celulă animală
Proteina sintetizată în polizomii celulei glandei endocrine - cel mai adesea un precursor al moleculei mari a hormonului peptidic (hormonul prepro)
Astfel, posibilitatea sintezei ARNm și translația acestui hormon sau precursorii săi specifici pentru aparatele nucleare și polizomilor tip particular de celule. Astfel, insulina și precursorii săi sunt produse în special în celulele insulelor Langerhans ale pancreasului, glucagon - in bine celulele-lor, hormon de creștere - în mici prolactina eozinofile anterior hipofizar - in celule mari eozinofilice ale aceluiași cancer, și gonadotropina - în celulele bazofile specifice și etc.
O excepție de la regula generală cai Biogeneza de polipeptide biosinteza hormonului astfel de factori de eliberare în celule ale hipotalamusului, ambele TRF si LH-RH. Sinteza acestor peptide mici nu pot să apară în polizomilor în matricea ARNm și porțiunea solubilă a citoplasmei sub influența specială pentru fiecare sisteme factor RF sintetaza constând dintr-un set de enzime specifice (Rayklin et al 1972, 1973 ;. Johansson et al 1973.).
Un webcast live a materialului genetic în sinteza majorității hormonilor polipeptidici duce adesea la formarea hormonului însuși nu este, și precursorii săi inactive - polipeptidici preprohormon (pregormony).
In astfel de cazuri, biosinteza hormonului polipeptidic constă în două faze: 1) sinteza ribozomal a inactiva matriță ARN precursor și 2) o formațiune post-translațională a hormonului activ. Prima etapă apare neapărat în celulele glandei endocrine, cea de-a doua - se realizează, de regulă, în glanda endocrină, dar se poate produce în afara acesteia.
Activarea post-translațională a precursorilor de hormoni (procesarea proteinelor) poate fi realizată în două forme: de molecule multiple de degradare enzimatice difuzate krupnomolekulyarnyh precursori cu mărime descrescătoare a moleculei (sau molecule) hormonului activabil (sau hormoni) și datorită nonenzimatici subunităților asociere progormonalnyh dimensiuni marirea molecula hormonului activabil . Aceste căi de educație sunt caracteristice nu numai hormonale, ci și altor proteine secretate (Neurath, 1977).
Prima formă de activare post-translațională se desfășoară mai des ca un proces în mai multe etape, realizat cu participarea unor proteaze specifice cu efect limitat. Ca urmare a traducerii, sub controlul genetic direct, în astfel de cazuri se formează un precursor de prepro-hormon de lungă durată cu moleculă mare. Acesta este în mod tipic un aminoacid hidrofob N-end și ușor pătrunde prin membrana reticulului endoplasmatic, care sunt asociate cu ansamblurile sale sintetizarea polizomilor.
La trecerea prin reticulul membranei are loc prin clivaj enzimatic pregormona porțiunea hidrofobă cu N-end a moleculei și în rezervoare formate reticul trunchiata molecula mai hidrofil și prohormonul. Prohormoni se deplasează din partea lichidă a citoplasmei (citosol) în granula secretorie, sau secretată în sânge ca o așa-numită hormoni „mari“. Sângele detectat, în special, o „mare“ insulina „mare“ hormon de creștere, „mare“ PTH etc. (Yalou, 1978, 1979).
În granulele celulei endocrine sau în afara ei, hormonul se degradează, se activează și devine un adevărat hormon. Cu toate acestea, hormonul activ poate fi, la rândul său, o prohormonă pentru alți compuși hormonali și transformată în ele prin acțiunea proteazelor țesuturilor periferice. Schema generală a procesului este următoarea:
Schema procesului de biosinteză a hormonilor proteină-peptidă
Proteazele cu efect limitat efectuează un control genetic indirect al biosintezei hormonilor de acest tip.
A doua formă de activare post-translațională este de obicei efectuată în interiorul celulelor endocrine și este caracteristică hormonilor glicoproteici dimerici. Schema acestor procese este după cum urmează:
A doua formă de activare post-translațională
Adăugarea resturilor de carbohidrați la subunități este un proces enzimatic. În plus, fiecare subunitate poate fi clivată enzimatic din pro-subunitate.
Prima formă de precursori activați ai hormonilor peptidici a fost bine studiat pentru biosinteza insulinei, hormon paratiroidian, angiotensina, in-lipotropina, ACTH și o serie de alți hormoni proteine și peptide. Luați în considerare aceste procese utilizând exemplul de biogeneză a insulinei în celulele din aparatul insulino-pancreatic (Steiner și colab., 1969, 1976). În prima etapă a sintezei hormonului în celula polizomilor peptida cu un singur lanț scurt sintetizat constând din resturile de aminoacizi 104-110, cu Mw-11500.
Această proteină de scurtă durată, nu posedă aktivnos biologice / preproinsulină sau preinsulinom Yu, el a fost numit. Într-un final / N-chain este o peptidă semnal hidrofobă 23-membri cuplat cu un lant al insulinei viitoare (30 reziduurile) la capătul C-terminal este A-STSp insulină (21 Reziduuri) și între B și Catenele este peptida intercalată (30-35 reziduuri de la diverse specii) (Fig. 27). Semnalul și peptidele intercalare sunt variabile în diferite specii de animale. Tancurile reticulum dur pe drumul de la polizomilor în granule secretoare preproinsulină este supus mai întâi la proteoliză cu N-end, în care peptida semnal scindată de 23 atomi, „trage“ pregormon prin membrana.
Ca rezultat, preproinsulină, proinsulina este transformată într - o singură polipeptidă catenară, care constă din resturile de aminoacizi 81-86 (MM - 9500) și are o activitate biologică scăzută. În granulele secretoare, proinsulina este transformată în insulină prin scindarea enzimatică a peptidei inserate. Acest proces are loc în două etape, cu participarea a doua grupuri de enzime: endopeptidase specifice asemănătoare tripsinei (enzima de conversie) determinând situsuri de clivaj Apr-Apr și Lys-Apr; carboxipeptidază-enzime (carboxipeptidaze B) care scindează 3 Apr și 1 Lys.
Ca rezultat al acestor enzime se formează o formă dublu catenară activă a insulinei (resturi de acid 51 aminoacizi, MM - 5700), o moleculă de legare sau peptidă-C (26-31 reziduu în diferite specii). 3 molecule de arginină și 1 moleculă de lizină. REZUMAT Mecanismul de activare, în acest caz, se reduce la excizia proinsulinei peptida clin molecula care prevede necesară pentru manifestarea înaltă activitate biologică orientarea spațială reciprocă a lanțurilor A și B legate prin două punți disulfidice.
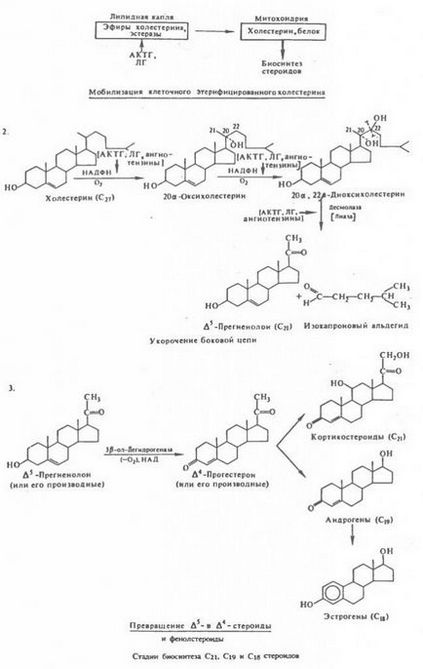
Etapele biosintezei C21, C19 și C18 sunt steroizi
Cele descrise principiu de activare hormoni proteine peptide în biosinteză lor pare a fi universal, dar poate varia în moleculele precursoare detaliu și degradarea în caracteristicile etapelor de localizare a țesutului. Astfel, un singur lanț peptidic - paratiroidian - (. 1974 Kemper și colab, 1976), format în celulele glandelor paratiroide prin degradarea secvențială a precursorilor săi krupnomolekulyarnyh cu capătul N-terminal al moleculei. Polizomii preproparatgormon sintetizat inițial, compus din 115 resturi de aminoacizi. După scindarea părții N-terminală a hormonului rest hidrofob 25-membri pregormona format paratiroidian (90 de resturi de aminoacizi). De la prohormonul în granule secretoare celulele glandei paratiroide formate după scindarea cu 6 membri N-fragment din molecula final progormonalnoy.
De la preatriopeptida (rest de aminoacid 151) este format în miocard primul proatriopeptid rezultat clivaj cu rest de semnalizare N-end 25 membri. Din cele din urmă, apoi se elimină ANF (124-151 reziduuri în pre-hormon) și cardiodilatină (26-92 de resturi în preformă).