3.4. Probleme și sarcini pentru soluții independente
1. Determinați pentru un gaz de echilibru: a); b); c) fracțiunea de molecule c; d) fracțiune de molecule c. Iată componentele vitezei moleculare de-a lungul axelor x, y, z. este cea mai probabilă valoare.
2. Gazul din moleculele cu masa m se află într-o stare de echilibru cu temperatura T. Scrie expresia pentru distribuția de probabilitate pentru componenta de viteză a moleculelor de gaz. Desenați dependențele pentru: a) într-un desen; b); c); d) unde este un număr. Care sunt ariile sub curbe egale?
3. Azotul are o temperatură de T = 600 K. Care este probabilitatea ca molecula de azot să aibă o viteză exactă egală cu 500 m / sec. Care este probabilitatea ca viteza moleculei să aibă o valoare în intervalul de la
= 499,5 m / s până la = 500,5 m / s?
4. Notați distribuția Maxwell ca funcție de variabila
unde este valoarea cea mai probabilă a modulului vectorului de viteză. Desenați un grafic al dependenței de densitatea de probabilitate
Arătați fracțiunea de molecule în care VV0. Care este zona sub curba?
5. Ce se întâmplă cu funcția maximă f (V) pentru: a) creșterea temperaturii gazului T; b) o creștere a masei moleculelor de gaz m. Cum se modifică numărul relativ al moleculelor "rapide" (VV0) și "lent" (VV0)
f (V) este densitatea de probabilitate pentru modulul de viteză moleculară.
6. Calculați valoarea medie a vitezei inverse utilizând distribuția Maxwell în valori absolute ale vitezelor moleculare.
7. Utilizarea distribuției lui Maxwell pentru (energii)
Găsiți cel mai probabil 0 și medie <> valorile energiei mișcării translaționale a moleculelor de gaz la temperatura T. Găsiți înălțimea maximului de distribuție. Desenați graficul funcției F () pentru două temperaturi: T și 2T. La ce energie * curbele se intersectează? Care sunt ariile sub curbe egale?
8. Care este concentrația n moleculelor de masă m în atmosfera izotermică (temperatura T) a planetei la o distanță r de centrul său (r-R
Unde R este raza planetei)? Masele planetei M. concentrația de molecule pe suprafața planetei n0. Desenați un grafic al dependenței lui n de r pentru rR.
9. Poate planeta să țină atmosfera izotermă pentru o perioadă nelimitată?
10. Gazul ideal (masa de molecule m) este într-un vas cu volumul V la temperatura T. Nu există câmpuri de forță exterioare. Găsiți distribuția de probabilități pentru coordonatele și componentele de viteză ale moleculelor de gaze.
11. Cum este necesar să schimbăm răspunsul la problema anterioară dacă gazul se află într-un câmp extern în care este potențiala energie a moleculelor de gaze? Înregistrați pentru acest caz.
12. Numărul total de molecule în gazul N Determinăm N este numărul mediu al acestor molecule de gaz într-un element cu volumul V = xyz. ale căror componente de viteză aparțin intervalelor. Nu există câmp de forță externă.
13. Distribuția probabilității pentru vectorul de viteză al moleculelor de gaz este cunoscută. Scrieți o expresie pentru vectorul de densitate a fluxului acelor molecule al căror vector de viteză aparține gama de concentrații a moleculelor n.
14. Scrieți o expresie pentru numărul de molecule de gaz încrucișate în direcția pozitivă a axei x în timp ce un tampon S. perpendicular pe această axă. Cunoscută: distribuția probabilității pentru componenta de viteză a moleculelor și concentrația de molecule n.
15. Diagramele (P, V) descriu un proces ciclic realizat cu un gaz ideal.
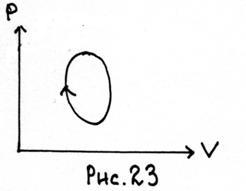
Determinați construcția punctelor A și B în care temperatura gazului T este minimă și maximă. Determinați zonele pe care T crește și scade.
16. Deasupra unui sistem a fost efectuată lucrarea d'A 'și informată despre căldura lui d'Q'. Găsește un job d'A '. pe care sistemul însuși le-a făcut și creșterea incrementală a energiei sale interne.
17. Atunci când un anumit sistem de lucru d'A 'a efectuat energia sa internă a experimentat un increment dU. Care este cantitatea de căldură "Q" primită de sistem?
18. La o presiune P, creșterea volumului sistemului este dV. Ce fel de muncă a făcut-o sistemul peste corpurile din jur? Ce este d'A '. dacă volumul sistemului: a) scade; b) crește? Găsiți căldura d'Q '. Valoarea obținută de sistem dacă creșterea energiei interne este dU.
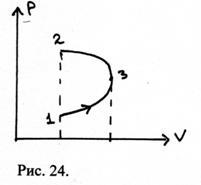
19. Diagrama (P, V) prezintă procesul efectuat de un anumit sistem. Pe ce secțiuni ale sistemului sunt pozitive? este negativ? Afișați în imagine lucrarea completă atunci când treceți de la starea 1 la starea 2.
20. Găsiți numărul i de grade de libertate pentru moleculele He, N2, CO2, H2O, CH4 (molecula CO2 este liniară, au loc toate tipurile de mișcări).
21. Este cunoscut numărul de grade de libertate i pentru moleculele de gaze. Folosind legea de echilibrare a energiei, găsiți energia medie <> moleculele unui gaz ideal la o temperatură T și energia internă U. Dacă: a) conține molecule N; b) ocupă un volum V la o presiune P. Express V în termeni de număr de moli de gaz.
22. Este cunoscută dependența energiei interne a gazului U (V, T) al sistemului de volumul V și temperatura T. Se calculează capacitatea de încălzire izochorică a sistemului CV.
23. Gazul ideal (exponentul adiabatic) este transferat din starea (P1, V1) la starea (P2, V2). Găsiți creșterea energiei interne.
24. Aerul din încăpere cu fereastră deschisă a fost încălzit de la T1 la T2. Care este creșterea U din energia internă a aerului din cameră?
25. Scrieți ecuația de stare a unui gaz ideal în parametrii pV și T. dacă se cunoaște CP și CV-ul acestuia.
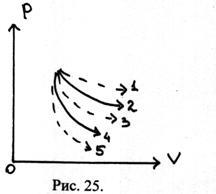
26. Diagrama (P, V) prezintă un număr de procese. Curba 2 este o izotermă; curba 4 este adiabat. Determinarea semnului capacității termice C în procesele 1, 3, 5. Care este capacitatea de căldură în procesele 2 și 4?
27. Unele sisteme la temperatura T primesc o cantitate elementară de căldură d'Q. Indicați relația dintre aceste cantități și incrementul de entropie dS al sistemului, dacă procesul: a) este quasistatic; b) nu este quasistatic.
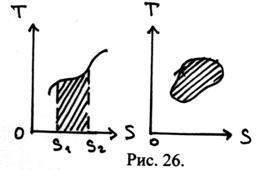
28. Diagrama (T, S) prezintă un proces quasistatic. Care este zona umbrită?
29. În prima clipă, unele sisteme închise sunt neechilibrate. Cum va varia probabilitatea w a macrostatului sistemului și a entropiei lui S pentru a descrie dependența S (t) calitativ și pentru a arăta în figură timpul de relaxare al sistemului.
30. Este posibil să se recalculeze microstatele în descrierea lor clasică într-un sistem format din particule de N?
31. Cu ajutorul entropiei S a unui gaz ideal, se calculează derivatele parțiale u, unde V este volumul și U este energia internă a gazului ideal.
32. Luați în considerare un sistem închis alcătuit din două subsisteme de echilibru cu volume constante și număr de particule. Subsistemele pot schimba căldura. Arătați că o condiție necesară pentru starea de echilibru a sistemului este egalitatea temperaturilor subsistemelor.
33. Motile unui gaz ideal cu un exponent adiabatic sunt transferate dintr-o stare în care presiunea P1 și volumul V1. într-o stare în care presiunea sa P2 și volumul V2. Determinați creșterea entropiei gazului S. Luați în considerare cazurile în care ambele state se află pe: a) un izobar; b) pe un izocor; c) pe o singură izotermă; d) pe un adiabat.
34. De câte ori va crește greutatea statistică a unui mol de gaz ideal cu o creștere izotermică a volumului cu un factor de două?
35. Estimați numărul mediu de molecule
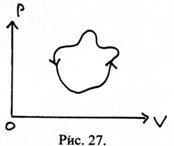
36. Figura prezintă un proces ciclic realizat cu un corp de lucru într-un anumit dispozitiv. Ce este acest dispozitiv: o mașină de încălzire sau un frigider?
37. Este posibil ca o mașină termică care utilizează ciclul Carnot să fie ireversibilă? Formați condiții suficiente pentru reversibilitatea unei astfel de mașini.
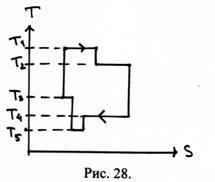
38. Câte încălzitoare și frigidere și cu ce temperaturi este necesar pentru realizarea mașinii termice utilizând ciclul prezentat în figura 28.
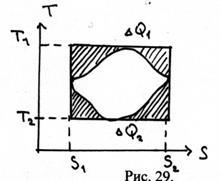
39. Calculați factorul de eficiență. ciclul prezentat în figura 29. T1, T2, S1 sunt cunoscute. S2 și zonele umbrite Q1 și Q2.
40. O mașină termică reversibilă pe ciclu consumă căldură Q1 de la încălzitor și transferă căldura Q2 către frigider. Ce fel de lucru trebuie făcut pe această mașină, astfel încât, lucrând în modul pompă de căldură, să pompeze căldura Q din frigider. Ce temperatură QH va primi încălzitorul?
4.1. Răspunsuri
1. a) 0; b) 0; c) ½; d) 1/8.
7. (proces adiabatic).
Deoarece ambele
8. Când se "formează" jumătate din moleculele formate, aburul emite energie. Apoi, energia cantității de gaz și de temperatură T1 poate fi găsit (inclusiv molecule „diatomice“ lipite)
În acest fel. Raportul presiunilor este definit ca raportul dintre temperaturi.
3.5. Întrebări de test
1. Ce se numește sistem termodinamic?
2. Care este starea unui sistem termodinamic?
3. Care set de parametri determină starea sistemului?
4. Care sistem termodinamic este omogen?
5. Ce este echilibrul termodinamic?
6. Ce sistem termodinamic se numește echilibru?
7. Ce este un sistem macroscopic?
8. Ce dificultăți apar atunci când descrieți un sistem macroscopic prin metode mecanice?
9. Care sunt parametrii macroscopici ai sistemului?
10. Ce parametri ai sistemului se numesc microscopici?
11. Cum se obțin valorile parametrilor macroscopici dacă sunt cunoscuți parametrii microscopici?
12. Care este metoda mediei medii?
13. Ce se numește densitatea de probabilitate?
14. Care este fluctuația relativă?
15. Ce este o fluctuație patratică?
17. Care este proprietatea unei cantități fizice, astfel încât fluctuația sa relativă să respecte teorema de fluctuație relativă?
18. Ce sisteme sunt denumite cvasi-închise și cvasi-independente?
19. Ce parametri caracterizează starea sistemului statistic?
20. Ce se numește funcția distribuției statistice?
21. Care este semnificația fizică a distribuției Gibbs?
22. Ce rol joacă distribuția Gibbs în fizica statistică?
23. Cum se calculează valoarea medie a unui parametru utilizând distribuția Gibbs pentru cazul unei distribuții discrete de energie?
24. Cum se calculează valoarea medie a unui parametru folosind distribuția Gibbs pentru cazul unei distribuții continue de energie?
25. Ce este entropia în fizica statistică?
26. Cum este calculată entropia în fizica statistică?
27. Care sunt condițiile pentru entropia statistică?
28. Care este caracteristica specifică a entropiei pentru sistemele în echilibru termodinamic?
29. Cum sunt legate energia, entropia și temperatura?
30. Care sunt proprietățile modelului "ideal gaz"?
31. Cum arata distributia probabilitatii impulsului unei molecule de gaze ideale?
32. Care este viteza RMS?
33. Care este energia cinetică medie a unui atom?
34. Cum arată formula Boltzmann?
35. Ce proces este asociat cu o schimbare a energiei interne a particulelor individuale, pentru care distribuția de probabilitate a sistemului termodinamic nu se schimbă?
36. Ce proces este asociat cu o schimbare a energiei interne a particulelor individuale, în care se schimbă distribuția probabilității sistemului termodinamic?
37. Cum arată distribuția Maxwell componentele vitezei unei molecule?
38. Cum arată distribuția Maxwell valorile absolute ale vitezelor moleculei?
39. Care este gradul de libertate?
40 Care este numărul de grade de libertate?
42. Care sunt caracteristicile gradelor de libertate a mișcării oscilante?
43. Cum arată expresia pentru numărul total de grade de libertate?
44. Care este formula pentru energia medie a unei molecule liniare formate din atomi n?
45. Care este formula pentru energia medie a formei unei molecule neliniare formate din atomi n?
46. Care este constanta lui Boltzmann?
47. Listează conceptele de bază ale termodinamicii.
48. Listați parametrii termodinamici de bază ai stării corpului.
49. Definiți căldura.
50. Dați definiția cantității de căldură.
51. Ce este transferul de căldură?
52. Cum se determină temperatura?
53. Care este temperatura absolută și empirică?
54. Cum se măsoară temperatura empirică?
55. Cum se măsoară temperatura absolută?
56. Care este scara termodinamică, în ce diferă de celelalte scale de temperatură?
57. Este posibil ca starea staționară a sistemului să fie echilibrată?
58. Care este ecuația statului?
59. Care este ecuația de stare a unui gaz ideal?
60. Ce este un proces termodinamic?
61. Ce proces se numește echilibru?
62. Este posibil ca un proces de echilibru să fie considerat reversibil?
63. Cum să implementați procesul de echilibru?
64. Ce este un proces cvasi-static?
65. Dați formula O-începutul termodinamicii.
66. Dați formula 1 - începutul termodinamicii.
67. Dați formula 2 - începutul termodinamicii.
68. Dați formula 3 - începutul termodinamicii.
69. Definirea energiei interne a unui gaz ideal.
70. Cum se determină munca elementară în termodinamică.
71. Ce înseamnă că schimbarea energiei interne este un diferențial total?
72. Dovada că o schimbare în cantitatea de căldură și de muncă nu este o diferență completă?
73. Cum arată prima lege a termodinamicii pentru procesul izocoric?
74. Cum arată prima lege a termodinamicii pentru procesul izobaric?
75. Cum arată prima lege a termodinamicii pentru un proces izotermic?
76. Cum arată prima lege a termodinamicii pentru procesul adiabatic?
77. Care este lucrarea în procesul izotermic?
78. Care este lucrarea în procesul izobaric?
79. Care este lucrarea în procesul adiabatic?
80. Care este lucrarea în procesul izocoric?
81. Care proces termodinamic se numește ciclic?
82. Care este particularitatea energiei interne în procesul termodinamic?
83. Care este modelul unui motor termic?
84. Cum arată modelul mașinii frigorifice?
85. În ce condiții poate fi folosit un motor termic ca mașină de răcire?
86. Ce este o mașină termică reversibilă?
87. Care este eficiența unui motor termic
88. Care este eficiența răcitorului de lichid?
89. Care este căldura redusă?
90. Care este eficiența ciclului Carnot?
91. Ce este ciclul Carnot?
92. Care este specificitatea ciclului Carnot în comparație cu alte cicluri?
93. Care este entropia termodinamică?
94. Care este specificitatea comportamentului entropiei într-un sistem închis?
95. Cum arată prima lege a termodinamicii folosind valoarea entropiei.
96. Care este energia legată?
97. Care sunt potențialul termodinamic?
Scrie expresia pentru energia liberă.
99. Scrieți o expresie pentru potențialul Gibbs.
100. Care este relația dintre entropia termodinamică și statistică și care este semnificația statistică a celei de-a doua lege a termodinamicii.
Literatura utilizată
2. Grigulevich. M. 1988, Lumea.
3. Kline N. Matematică. Căutați adevărul. M. 1988.
5. Aristotel. Lucrări. T. 3. M. 1981.
6. Shooterii. M. 1975.
7. Spassky pentru filosofi. Universitatea de Stat din Moscova, 1988.
8. Teoria energiei electrice Tamm. M. 1988.
9. Kozeletsky Yu. Teoria psihologică a soluțiilor. M. 1979, Progress.
11. Yakovlev, Probleme în cursul general al fizicii. Partea I. I. M. 1960.
12. Dicționar enciclopedic fizic. M. Enciclopedia sovietică, 1983.
15. Putilov de fizică. T. I, II. M. 1954, ed. Tech. teor. literatură.
16. fizica teoretică Levich. T. 1. M. 1962, Fizmatgiz.
17. Livste fizicianul. M. 1964, ed. Știință.
18. Laue M. Istoria fizicii. M. 1956.
19. Despre posibilul și imposibilul în știință. M. 1988.
21. Popov privind rezolvarea problemelor fizicii moleculare.