§ 6. AMINO ACIZI CA ELEMENTE STRUCTURALE A PROTEINELOR
Aminoacizii din organismele vii se găsesc în principal în proteine. Proteinele sunt construite în cea mai mare parte de douăzeci de aminoacizi standard. Acestea sunt a-aminoacizi și diferă una de cealaltă în structura grupelor laterale (radicali), notată cu litera R:
Varietatea radicalilor laterali ai aminoacizilor joacă un rol-cheie în formarea structurii spațiale a proteinelor, cu funcționarea centrului activ al enzimelor.
Structura aminoacizilor standard este dată la sfârșitul paragrafului din tabelul 3. Aminoacizii naturali au nume trivial, este inconvenient să funcționeze cu înregistrările structurii proteice. Prin urmare, pentru acestea sunt introduse denumirile cu trei litere și o singură literă, care sunt prezentate și în tabelul 3.
În toți aminoacizii, cu excepția glicinei, atomul a-carbon este chiral, adică ele sunt caracterizate prin izomerism optic. În tabel. Atomul de carbon chiral este indicat printr-un asterisc. De exemplu, pentru alanină, proiecțiile Fisher ale ambilor izomeri sunt după cum urmează:
Pentru desemnarea lor, în ceea ce privește carbohidrații, se utilizează nomenclatura D, L. Compoziția proteinelor include numai L-aminoacizi.
Izomerii L- și D se pot converti reciproc unul în celălalt. Acest proces se numește racemizare.
Aminoacizii conțin grupe amino și carboxil. Din această cauză, ele prezintă proprietăți amfoterice, adică proprietăți ale acizilor și ale bazelor.
Când un aminoacid este dizolvat în apă, de exemplu, glicina, gruparea carboxilică disociază pentru a forma un ion de hidrogen. În plus, ionul de hidrogen este atașat datorită unei perechi de electroni împărțită în comun de la atomul de azot la gruparea amino. Se formează un ion în care sunt prezente simultan încărcări pozitive și negative, așa-numitul ion zwitterion:
Această formă de aminoacid este predominantă într-o soluție neutră. Într-un mediu acid, un aminoacid, atașând un ion de hidrogen, formează un cation:
Într-un mediu alcalin se formează un anion:
Astfel, în funcție de pH-ul mediului, aminoacidul poate fi încărcat pozitiv, încărcat negativ și neutru din punct de vedere electric (cu încărcături pozitive și negative egale). Valoarea pH a soluției, la care încărcarea totală a aminoacidului este zero, se numește punctul izoelectric al aminoacidului dat. Pentru mulți aminoacizi, punctul izoelectric se află în apropierea pH-ului 6. De exemplu, punctele izoelectrice ale glicinei și alaninei au valori de 5,97 și, respectiv, 6,02.
Doi aminoacizi pot reacționa unul cu celălalt, în urma căruia molecula de apă se separă și se formează un produs numit dipeptidă.
Legătura care leagă doi aminoacizi se numește o legătură peptidică. Dacă folosim denumirile literelor de aminoacizi, formarea unei dipeptide poate fi reprezentată schematic după cum urmează:
În mod similar, se formează tripeptide, tetrapeptide, etc.:
H2N - lys - ala - gli - COOH - tripeptid
H2N - trp - gis - ala - ala - COOH - tetrapeptid
H2 N-tier-lys-gli-ala-leu-gli-trp-COOH-heptapeptidă
Peptidele care constau dintr-un număr mic de reziduuri de aminoacizi sunt numite colectiv oligopeptide.
Este interesant să știți! Multe oligopeptide au o activitate biologică mare. Acestea includ un număr de hormoni, cum ar fi oxitocina (nanopeptid) stimulează contracțiile uterine, bradikinina (nanopeptid) inhibă procesele inflamatorii în țesuturi. Antibioticul gramicin S (decapeptidă ciclic) dă reglarea permeabilității ion în membrana bacteriilor și, prin aceasta, le distruge. toxine micotice amanitin (octapeptic) prin blocarea sintezei de proteine, poate provoca intoxicații grave la om. Aspartam - esterul metilic al aspartilfenilalaninei este cunoscut. Aspartamul are un gust dulce și este folosit pentru a conferi un gust dulce diferitelor produse alimentare și băuturi.
Există mai multe abordări ale clasificării aminoacizilor, dar cea mai preferată este clasificarea bazată pe structura radicalilor lor. Există patru clase de aminoacizi care conțin radicali de următoarele tipuri; 1) nepolar (sau hidrofob); 2) descărcat polar; 3) încărcate negativ și 4) încărcate pozitiv:
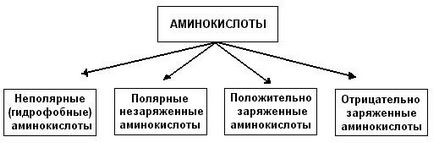
Prin nepolari (hidrofobi) includ aminoacizii nepolari alifatici (alanină, valină, leucină, izoleucină) și aromatici (fenilalanină și triptofan) R-grupe și un conținut de sulf de aminoacizi - metionină.
Neîncărcate aminoacizi polari comparativ cu nonpolar sunt mai solubili în apă, mai hidrofil, deoarece grupurile lor funcționale formează legături de hidrogen cu moleculele de apă. Acestea includ aminoacizi având polar HO-grup (serină, treonină și tirozină), HS-grup (cisteină), amidă (glutamina, asparagina) și glicină (R-grup de glicină, prevăzut cu un atom de hidrogen este prea mic pentru a compensa polaritatea puternică a grupării a-amino și a grupării a-carboxil).
Acizii aspartici și glutamici aparțin aminoacizilor încărcați negativ. Acestea conțin două grupări carboxil și o grupă amino, astfel încât în starea ionizată moleculele lor vor avea o încărcare negativă netă:
Aminoacizii încărcați pozitiv aparțin lizinei, histidinei și argininei, în formă ionizată, au o încărcare netă pozitivă:
În funcție de natura radicalilor, aminoacizii naturali sunt, de asemenea, subîmpărțiți în aminoacizi neutri, acizi și bazici. Neutrul se referă la încărcături nepolare și polar, încărcate acid - negativ, la cele principale - încărcate pozitiv.
Zece dintre cei 20 de aminoacizi care alcătuiesc proteinele pot fi sintetizați în corpul uman. Restul trebuie să fie conținut în mâncarea noastră. Acestea includ arginina, valina, izoleucina, leucina, lizina, metionina, treonina, triptofan, fenilalanină și histidină. Acești aminoacizi sunt numiți de neînlocuit. Aminoacizii esențiali sunt adesea incluși în aditivii alimentari, utilizați ca medicamente.
Este interesant să știți! Un rol extrem de important îl are echilibrul alimentației umane în aminoacizi. Cu o lipsă de aminoacizi esențiali în alimente, organismul se auto-distruge. În același timp, creierul suferă în primul rând, ceea ce duce la diferite boli ale sistemului nervos central, tulburări mintale. Organismul tânăr în creștere este deosebit de vulnerabil. De exemplu, prin încălcarea sintezei de tirozină de fenilalanină la copii în curs de dezvoltare a bolii severe finilpirovinogradnaya retard mintal care determină retard mintal sever sau deces al copilului.