Cum formează Melt
Solidificarea magmei este procesul de creștere a cristalului din topituri. Când se încălzește, se topesc substanțele solide (cu excepția cazului în care, desigur, nu ard sau se descompun în părțile componente). Dar se pare că cristalele și substanțele amorfe (ochelari) se topesc foarte diferit.
Fiecare substanță cristalină începe să se topească complet la o anumită temperatură. Se încălzește în sus, de exemplu, cristale de staniu și, astfel, se va măsura temperatura de 100, 200, 220, 225 ° C - nu schimbă cristalul. Dintr-o data la 231,9 ° C, cristalul începe să se topească. Nu contează cât de multe ori repetăm această experiență, nu vom fi în măsură să se topească cristalul de staniu, la 231 ° C sau mai mici, și vice-versa, nu putem să-l păstrați la 232 ° C sau mai sus - începe întotdeauna să se topească la 231,9 ° C, cu excepția cazului în numai experiența realizată la presiune atmosferică și în nici un impurități de staniu.
Și dacă nu există nici un fenomen de hipotermie, care va fi discutată mai jos.
Vom continua să se încălzească topirea cristalelor de staniu. Deși temperatura de încălzire staniu crește nu mai: în timpul întregii topirea rămâne egală cu 231,9 ° C. Numai când topirea este completă, Tin temperatură - nu mai este cristalul și un lichid de topitură - va începe să crească, dacă nu se continuă încălzirea .
Cristalul de sare se topește la exact 804 ° C, cristale de cuarț, la 1470 ° C Toate cristalele se topesc la o anumită temperatură numită temperatură de topire. La această temperatură, structura cristalină se prăbușește, descompune funcționarea corectă a particulelor ca crumbles comandate de sportivi de pe echipa „rupe!“. Pentru toate cristalele din aceeași substanță în condiții constante de temperatură de topire este aceeași, dar este diferit de substanțe diferite. Toate cristalele în timpul de topire menține o temperatură constantă. Este această proprietate a dispozitivului pe bază de cristal este un termometru. Zero grade Celsius termometru - temperatura la care, în condiții normale de topire, adică se topesc cristale de gheață.
Dar ce putem spune despre solidele non-cristaline se topesc? Încălzirea oricărui material amorf, cum ar fi un pahar simplu, nu mai suntem capabili de a determina temperatura la care începe să se topească, astfel încât materialul amorf este topit treptat, se înmoaie, devine mai puțin și mai puțin vâscos și eventual complet lichid. Acest lucru este de înțeles: la urma urmei, nu este nevoie de nici o echipă pentru a sparge sistemul, din moment ce toate particulele de sticlă, chiar înainte de încălzire aranjate aleatoriu.
Dacă sticla se topește imediat, ca un cristal, ar fi imposibil să explodezi și să mucești vasele din ea. Doar pentru că geamul se înmoaie sau îngheață treptat, suflanta poate sufla și sculpta, dându-i orice formă.
Având o temperatură de topire constantă distinge corpurile cristaline din non-cristaline. Cristalele încep să se topească imediat la o anumită temperatură și nekristally (și multe amestecuri de substanțe cristaline) înmoaie treptat - nu au nici un punct de topire definit ". Pe această bază se poate distinge o substanță cristalină dintr-un non-cristalin. De exemplu, gheața începe să se topească la zero grade, apoi gheața - substanța este cristalină și rășina, asfalt, materiale plastice, gelatină, Var, lipici dulgher înmuiat treptat, - mijloace, aceste substanțe nu sunt cristaline, dar amorfă.
Dar punctul de topire al cristalelor aceleiași substanțe este întotdeauna același? Nu o poți schimba? Se pare că poți. Faptul este că punctul de topire al cristalului depinde de presiunea în care se află acest cristal. De exemplu, gheața se topește, adică se topește la 0 ° C numai sub presiune normală (într-o atmosferă). Dacă măriți presiunea, gheața se poate topi la o temperatură mai scăzută, chiar la câteva grade sub zero. Sub presiune care depășește 100 de ori presiunea atmosferică normală, gheața se topește la - 0,9 ° C, iar dacă presiunea este de o mie și jumătate de mie de ori mai mare decât presiunea atmosferică, gheața se topește deja la -14,1 ° C
Presiunea afectează punctele de topire ale tuturor cristalelor, iar efectul este diferit pentru diferite substanțe: în unele este mai puternic, în altele este mai slab; pentru unele substanțe, pe măsură ce crește presiunea, temperatura de topire crește, în timp ce în altele, dimpotrivă, scade. Acest lucru este valabil mai ales în adâncurile Pământului, unde presiunea acționează de milioane de ori mai mare decât pe suprafața sa. Prin urmare, în adâncurile Pământului, cristalele se topesc la alte temperaturi decât în laboratoare. Dar chiar și acolo cristalele încep să se topească neapărat la o anumită temperatură, numai această temperatură este o presiune specială pentru fiecare regiune.
Temperatura topirii este afectată, în plus față de presiune, de alte cauze, de exemplu impuritățile altor substanțe din topitură. De exemplu, punctele de topire ale fierului pur și siliciului pur sunt foarte ridicate, iar amestecul de oxizi ai acestor elemente cu var se topește la o temperatură mult mai scăzută. Aceasta este baza metodei de topire a fierului din minereurile care conțin silice. Se adaugă calcar în amestecul de minereu; silice, var și o mică parte a fierului formează o zgură cu punct de topire scăzut care iese și se separă de fierul mai refractar.
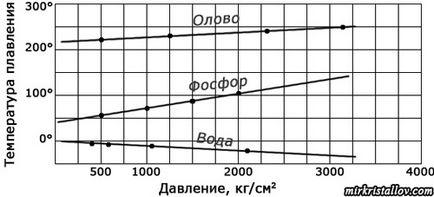
Dependența punctului de topire al unor substanțe la presiune.
Dacă adăugăm la sarea de masă obișnuită de gheață, temperatura de topire a gheții este puternic redusă. Este cunoscut faptul că apa de mare sarata îngheață la o temperatură mai scăzută decât apa proaspătă. Un amestec format dintr-o parte din sare și trei părți de apă nu se topește la temperatura de 0 °, dar numai la -23 ° C Amestecarea gheață cu clorură de calciu, scaderea temperaturii se poate realiza până la -55 ° C. Această proprietate de cristale de gheata folosite pentru prepararea de refrigerare dacă se presară gheață cu sare, de exemplu, în filtru de înghețată, temperatura de topire a gheții este redus dramatic.