
Acasă | Despre noi | feedback-ul
În apele naturale nu apar una sau mai multe reacții de reducere a oxidării. Aceste reacții sunt asociate cu prezența elementelor care sunt capabile să-și schimbe sarcina în funcție de potențialul electric al soluției. Prin urmare, potențialul de reducere a oxidării soluției ca întreg este determinat de natura și concentrația acestor elemente. Acele componente care afectează în mod semnificativ potențialul de reducere a oxidării din soluție sunt numite electroactive. Elementele a căror concentrare și formă de existență controlează de fapt potențialul de oxidare-reducere al soluției se numește potențialul ca forță motrice. În apele naturale, acestea pot fi O, S, C, N și Fe. Soluțiile care conțin concentrații suficient de mari ale unor astfel de componente și, prin urmare, aproape nu modifică potențialul de reducere a oxidării atunci când se adaugă oxidanți sau agenți reducători sunt numiți tampoane redox.
Potențialul de reducere a oxidării soluției ca întreg poate fi determinat în trei moduri:
1 - prin concentrațiile componentelor unei singure perechi redox,
2 direct cu un electrod standard de hidrogen și
3 - prin conținutul relativ al componentelor electroactive în soluție.
1. În primul caz, potențialul de reducere a oxidării este determinat de concentrațiile relative ale componentelor unei perechi de roduce. În mod obișnuit, astfel de perechi sunt alese dintre metalele de tranziție, cel mai adesea Fe 3+ și Fe 2+. Aceste metale nu sunt întotdeauna potențialul de conducere, dar ajung la relativ rapid concentrațiile de echilibru determinate de valoarea Eh a soluției. Această metodă de estimare a valorii Eh este prezentată în exemplul II-6.
În apă proaspătă s-a găsit 10-3,3 mol / l de Fe2 +. și 10-5,9 mol / l Fe 3+. Este necesar să se determine valoarea Eh a soluției.
Să presupunem că concentrațiile acestor ioni de fier sunt echilibrate. Ele reacționează în funcție de jumătate de reacție: Fe 3+ + e - Fe 2+. Potențialul electrodului standard al acestei reacții este de 10 g KFe = -13, ze = 1. În apa proaspătă, coeficienții de activitate pot fi echivalenți cu 1.
Există două soluții posibile.
Metoda 1: În echilibru, ecuația este:
.
Apoi. Eh = 0,059 # 8729; 10,4 = 0,61 V.
Metoda 2: Conform ecuației Nernst
= 0,771-0,059 lg (10-3,3 # 8729; 10 +5,9) = 0,77-0,15 = 0,62 V
În consecință, apa are un potențial redox de +0,62 V, care este cu 0,15 V mai mic decât este necesar pentru echilibru. O astfel de soluție are un deficit de electron și este un agent de oxidare.
Cu toate acestea, reacțiile de reducere a oxidării în soluție se desfășoară la rate diferite, valoarea cărora depinde adesea de conținutul și natura microorganismelor. Cele mai rapide reacții de reducere a oxidării dintre metale (de exemplu, Fe2 + ↔ Fe3 +, Sn2 + ↔Sn4 +, etc.), ale căror timpi de înjumătățire sunt măsurate cu minute sau ore, sunt considerate cele mai rapide. Reacțiile redox cu anioni, în special cu materii organice, cu participarea O2 și hidroliză, sunt mult mai lente. Acest lucru se datorează faptului că aceste reacții au energii de activare ridicate asociate cu distrugerea legăturilor covalente puternice. Multe dintre aceste procese de reducere a oxidării în condiții naturale se realizează numai prin cataliză biochimică (de exemplu, N2 → NO2 - → NO3 -). Ratele acestor procese sunt foarte scăzute și instabile: populațiile microbiene trebuie să se adapteze mediului și să intre în contact direct cu perechile redox. Numai oxidarea sulfului sulfurat într-un mediu alcalin poate fi atribuită proceselor destul de rapide. Multe reacții redox sunt prea letale datorită constantelor de echilibru extrem de mari și sunt, în esență, ireversibile. Timpul de înjumătățire al acestor reacții poate ajunge la câțiva ani. Prin această valoare, Eh a perechilor redox individuale rareori poate fi criteriul potențialului redox al soluției ca întreg.
Cu toate acestea, această metodă este utilizată pentru a determina potențialul tamponului redox, care, de regulă, este exprimat de valoarea fugacității de echilibru a oxigenului. În acest caz, oxigenul este utilizat ca donator de electroni în reacțiile de reducere a oxidării. Apoi, reacția de oxidare a fierului are forma:
dar oxidarea sulfului:
Aici, activitatea oxigenului este utilizată ca indicator sau indice al condițiilor redox, indiferent dacă există sau nu oxigen în sistem. În condiții de echilibru, ultima reacție are activități legate de mărimea constantei de echilibru:
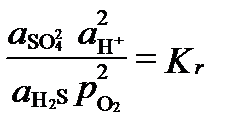
Potențialul de reducere a oxidării acestei situații de echilibru poate fi exprimat prin valoarea fugacității oxigenului, care la Kr = 10 126 și pH = 7 este egală cu:
De obicei, potențialul tamponului redox este determinat de raportul dintre formele minerale ale elementelor diferitelor stări de oxidare. În rocile sedimentare, reacția magnetitului la hematit este utilizată ca indicator:
Condițiile de oxidare a sedimentării și a condițiilor de diagenesă sunt caracterizate de obicei prin fugacitatea oxigenului de la 0,2 atm la suprafață la 10-70 atm în condiții standard.
2. Determinarea valorii Eh a soluției utilizând un electrod standard de hidrogen este mai fiabilă. În acest caz, potențialul de reducere a oxidării este determinat direct în apă, comparându-l cu potențialul unui electrod hidrogen standard. a cărui valoare este considerată egală cu 0. Dispozitivul acestui electrod este prezentat în Fig. II-8
Figura II-17. Principiul de comparare a soluției Eh cu potențialul unui electrod standard de hidrogen. A este apa de testare, B este electrodul standard de hidrogen.
Valorile lui Eh, măsurate în acest fel, caracterizează devierea unor potențiale medii, nu neapărat echilibrate # 8710; soluție ca un întreg de la potențialul unui electrod standard de hidrogen:
Trebuie avut în vedere că în condiții reale, potențialul electrodului de hidrogen nu este egal cu 0. Potențialul său este determinat de ecuația:
Dacă E 0 H = 0,0 V, a = 1 atm, atunci:
Coeficienții activității acizilor obișnuiți sunt bine studiate. Prin urmare, la o temperatură de 25 ° C și = 1 atm:
Această ecuație caracterizează corecția, care este de obicei luată în considerare automat și minimizează erorile în determinarea soluției Eh din cauza instabilității pH-ului electrodului hidrogen.
În plus, atunci când se măsoară Eh cu un electrod, este necesar să se ia în considerare influența interacțiunii electrodului cu apa testată, anume coroziunea sau adsorbția particulelor pe suprafața sa. De exemplu, atunci când un electrod bogat în Fe2 + cu O2 adsorbit este scufundat în apă fără anoxie, FeOOH poate precipita pe suprafața sa, ceea ce afectează în mod semnificativ electroactivitatea acestuia. Măsurătorile Eh prin metoda electrodului sunt cele mai fiabile atunci când se studiază ape acide cu concentrații ridicate de Fe 2+ și Fe 3+.
Valorile Eh, măsurate folosind un electrod standard, conțin o anumită incertitudine. Este evident că soluțiile cu o valoare mai mare a lui Eh joacă rolul unui oxidant în ceea ce privește soluțiile cu o valoare mai mică a lui Eh. Dar aceasta nu înseamnă că toate reacțiile redox ale soluției sunt în echilibru și au aceeași magnitudine de potențial de reducere a oxidării.
Din acest motiv, valorile Eh (pe) calculate pentru diferite perechi de rhodix din aceeași soluție și metoda electrodului oferă o gamă largă de valori. În cele mai multe cazuri, rezultatele obținute prin metoda electrodului sunt slabe comparabile cu rezultatele obținute de la perechile de rhodix. Acest lucru este văzut în figura II-9, unde valorile Eh măsurate în câmp prin metoda electrodului sunt comparate cu valorile lui Eh calculate de perechile de rhodix.
Motivul principal al acestei variații este absența unui echilibru complet al reacțiilor de reducere a oxidării în apele naturale. Prin urmare, valorile Eh ale metodei electrodului, ca regulă, nu pot fi atribuite nici unei perechi redox speciale și folosite pentru interpretarea interacțiunii componentelor sale. O excepție poate fi cazul în care electrodul utilizat este sensibil la o singură pereche de ritmuri. În schimb, valoarea lui Eh, calculată din concentrațiile unei perechi redox individuale, nu poate fi utilizată pentru a caracteriza potențialul redox al soluției ca întreg.
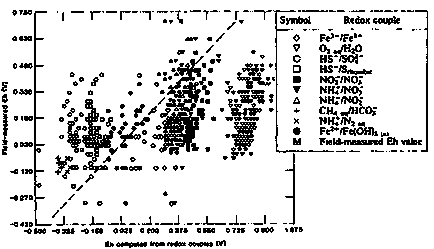
Figura II-18. Comparația măsurătorilor electrodului de câmp Eh în apele subterane cu potențiale calculate în funcție de perechile individuale de rox (Lindberg, R. D. Runnells, D. D. 1984).
3. în final, potențialul de reducere a oxidării soluției poate fi calculat dacă toate perechile redox din compoziția sa sunt cunoscute și este permis echilibrul lor chimic complet.
Într-adevăr, dacă există reacții J rendex care merg simultan și necesită electroni ve, j pentru fiecare act de schimb, atunci numărul total de electroni implicați în procesele redox ale soluției este. Apoi, munca maximă utilă a tuturor oligoelementelor galvanice ale soluției, conform ecuației II-149, este:
În același timp, entalpia liberă minimă a tuturor acestor reacții, conform ecuației II-91, este:
unde și sunt valorile potențialelor molare standard ale entalpiei libere a produselor și reactivilor tuturor reacțiilor redox, entalpiile minime libere ale acestor reacții la echilibru și ve și j sunt numărul de electroni care participă la aceste reacții. Comparând ultimele două ecuații, obținem:
CO2 + 2H + + 2e = CO + H20 (= -0,104 V)
CO + 2H + + 2e = C + H20 (= 0,518 V)
CO2 + 4H + + 4e = C + 2H20 (= (2 x 0,518-2 × 0,104) / 4 = 0,207 V)
Valoarea caracterizează potențialul total de reducere a oxidării din soluție în condițiile echilibrului său chimic complet. Totuși, acest echilibru în apele naturale, de regulă, este absent datorită unei mari diferențe în ratele de reacții redox. În legătură cu aceasta, pentru a estima valoarea reală a echiv. este necesar să se țină seama de activitatea efectivă (concentrația) componentelor care participă la reacțiile redox ale ratura. Apoi, în conformitate cu ecuațiile II-150 și II-153 Eh, soluția ca întreg este: