ARNm - constă în adăugarea regiunii CEP și asamblarea coadă de poliadenil +.
tRNA - se maturizează prin metilarea bazelor azotate și se adaugă un situs acceptor de îmbinare CTC +.
rRNA - fragmente de toate tipurile de ARN 18S sunt tăiate dintr-un precursor mare; 5S; 5,8S; 28S; + splicing.
Este posibilă alianța alternativă - constă în faptul că pentru diferite proteine intronurile pot servi drept exoni și invers.
Sinteza posibilă non-matrice și ARN-ul este derivat de la un nucleozid di-fosfați și enzimă implicată polinukleatidfosforilaza molecule sintetizate standard de ARN mici, care sunt necesare pentru proteinele standard.
Astfel, în organism, transferul de informații genetice este transmis în direcția ADN-ului → ARN →→→D protein. Cu toate acestea, în unele BIOS, fagii, țesuturi embrionare sinteza ADN prin matriță ARN (ARN → ADN) această enzimă catalizează sinteza ADN polimerazei ARN dependentă (revers transcriptaza, reverstranscriptaza). O variantă a ARN → ARN (în virusuri) este de asemenea implicată aici, este implicată replicaza ARN.
Biosinteza proteinelor (traducere).
Structura de bază a proteinelor sintetizate este structura primară (secvența aminoacizilor cu PPC), această secvență fiind încorporată în codul genetic al ADN-ului. Codul genetic are următoarele caracteristici:
1. triplet - constă în faptul că un aminoacid este codificat de trei dintre cele patru nucleotide ale speciilor de ADN cu codul triplet nucleotidice 64 posibile combinații diferite de 20 de aminoacizi, care este suficient pentru codificare.
2. Unicitatea - 1 triplă codifică numai 1 aminoacid.
3. Degenerarea - pentru codificarea unui aminoacid există mai multe triplete
4. Continuitate - între tripleți nu există nucleotide care să nu aparțină tripletelor vecine.
5. Non-suprapunere - o nucleotidă nu poate aparține simultan tripletelor a 2-a.
6. Universalitatea - codul în diferite organisme este identic pentru aceiași aminoacizi.
Astfel, codul ADN este liniar continuu și unidirecțional. Secvența de nucleotide corespunde strict secvenței aminoacizilor din proteina - colinearitatea sintetizată.
Pentru traducere, sunt necesari următorii factori:
- Toate tipurile de ARN (t, u, p)
- Aminoacizi
- Macroenergii (donatori de energie)
- enzime
- Factori suplimentari de proteine
- Mg2 +
În prima etapă pregătitoare, aminoacidul este activat și legat la ARN-ul său de transport. În această etapă, sunt implicați enzimele amino-acil-tRNA sintetazei. Acestea sunt enzime specifice care asigură conectarea aminoacidului cu tARN corespunzător.
Inițierea sintezei proteinelor are loc în timpul formării complexului inițial, care include codonul de inițiere mRNA + (ASC, ASU). Lui CEP-ul ARNm se leagă la subunitatea mică a ribozomului la codonul de inițiere ARNt atașat cu primul său aminoacid, metionină adesea.
Elongația implică închiderea unei legături peptidice, translocarea ribozomi pe ARNm care unește subunitatea mare ribozomale. Toate aceste etape necesită energia GTP și ATP. Prin subunitatea mică și subunității mari unește două porțiuni funcționale este formată pe porțiunea p ribozom (peptidil) și o porțiune (aminoacil). Primul ARNr cu primul AK este atașat la situl p, iar site-ul a este liber. La acest situs a, un al doilea tRNA cu un al doilea aminoacid se alătură anticodonului său. Sub acțiunea enzimei peptidil desprinse din primul aminoacid și ARNt este mai întâi legat la al doilea aminoacid este format di-peptidă. Ulterior, deplasarea (translocarea) ribozomului de-a lungul ARNm este de 3 nucleotide. În acest caz, cel de al doilea tRNA cu peptida apare în regiunea peptidil, iar a-site-ul este eliberat. Primul tRNA părăsește ribozomul și lasă citozolul pentru un nou ak, iar un al treilea ARNm se alătură site-ului a. Dipeptidul este apoi transferat la al treilea aminoacid → tripeptid. Sinteza PPC are loc de la capătul N-terminal până la capătul C-terminal.
Terminarea are loc atunci când complexul se apropie de codonul terminator (UAG, UGA). Acest codon nu corespunde niciunui tARN → nu este introdusă nicio AK nouă și sinteza proteinelor este terminată.
Multe proteine sintetizate sunt ulterior supuse unui astfel de proces ca modificarea post-translațională. Există mai multe opțiuni pentru PM. Cea mai comună este:
- proteoliza parțială - scindarea locurilor inutile (pro-enzima → enzima, pro-hormonul → hormonul)
- modificarea AK individuale:
Ø oxidare (prolină → hidroxiprolină în colagen);
Ø fosforilarea (fosforilaza);
Ø glicozilarea (adaos de carbohidrat);
Ø Carboxilarea (adăugarea unui nou COOH - trombină → trombină activă)
- aderarea la grupul protetic
- închiderea podurilor di-sulfură
- modificarea oligomerității proteinelor
În PM joacă un rol important de proteine-chaperones, ei monitorizează corectitudinea modificării.
În practica clinică, inhibitorii sintezei acizilor nucleici și proteinei în microorganisme sunt utilizați ca medicamente antibacteriene.
La etapa de replicare:
Antimicina D - care este încorporată într-o moleculă de ADN și blochează sinteza unui ADN nou
Novoviatsin - inhibă ADN-giraza (topoizomeraza)
La etapa de transcriere:
Rifamicina blochează ARN polimeraza
În etapa de difuzare:
Tetraciclina, levomicitina - leagă fie o subunitate mică sau mare a ribozomului, blocând astfel sinteza proteinei.
Penicilina - blochează sinteza proteinelor care intră în plicul microorganismelor.
REGLEMENTAREA SINTEZEI DE PROTEINE.
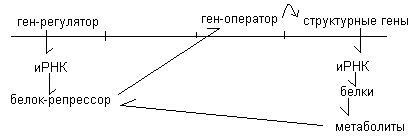
Concentrația mare de proteine și metaboliți conduce la faptul că metaboliții se leagă de regresor și îl activează. Compresorul activ suprimă gena operatorului și genele structkturnye.