4. Sistemul tampon proteic este format din "baza de proteine" și "proteina-sare".
R este CH + H + # 219; R este CH
Echilibrul corespunzător acid-bază în mediu apropiat de neutru este mutat spre stânga și "baza de proteine" prevalează.
Partea principală a proteinelor plasmatice din sânge ( „90%) sunt albumine și globuline. Punctul izoelectric al proteinelor (numărul cationic și grupe anionice ale acestora, taxa de molecule de proteine este zero) se află într-un mediu slab acid la pH 4.9-6.3, prin urmare, în condiții fiziologice la pH 7,4 proteine sunt mai ales în formele de „proteine-bază „și“ proteine și sare. "
Capacitatea tampon, determinată de proteinele plasmatice, depinde de concentrația proteinelor, structura lor secundară și terțiară și numărul de grupuri libere de proton acceptor. Acest sistem poate neutraliza atât produsele acide, cât și cele de bază. Cu toate acestea, datorită predominării formei "protein-base", capacitatea tampon este mult mai mare în acid și face ca albuminele Bk = 10 mmol / l, iar pentru globuline Bk = 3 mmol / l.
Capacitatea tampon a aminoacizilor liberi ai plasmei sanguine este nesemnificativă atât în acid cât și în alcaline. Aceasta se datorează faptului că aproape toți aminoacizii au valori pKa. foarte departe de pKa = 7. Prin urmare, la pH fiziologic, puterea lor este scăzută. Practic, un singur aminoacid - histidină (pKa = 6,0) are un efect de tamponare semnificativ la valori ale pH-ului apropiate de pH-ul plasmei sanguine.
Astfel, puterea sistemelor tampon ale plasmei sanguine scade în direcție
Eritrocite. Mediul intern al eritrocitelor menținut în mod normal, la un pH constant de 7,25. Sistemele tampon de hidrocarbura și fosfat funcționează aici, de asemenea. Cu toate acestea, puterea lor diferă de cea din plasmă. Mai mult decât atât, în eritrocite sistem proteic hemoglobină, oxihemoglobină joacă un rol important în procesul de respirație (funcției de transport a transportului de oxigen la țesuturi și organe și îndepărtarea acestor CO2 metabolice) și în menținerea pH constant în eritrocite, ca urmare, și în sânge în general. Trebuie remarcat faptul că sistemul tampon în celulele roșii din sânge strâns asociate cu sistemul vodorodkarbonatnoy. Deoarece pH-ul în eritrocite 7.25, raportul dintre concentrația de sare (HCO3 -). Și un acid (CO3 H2) este ceva mai mică decât în plasma din sânge. Deși capacitatea de tamponare a acestui sistem în cadrul acidului eritrocitelor este ceva mai mică decât în plasmă, menține în mod eficient permanența pH-ului.
Fosfolipidele sunt acizi relativ slabi. Valorile pKa ale disociației grupărilor fosfatice variază de la 6,8 la 7,2. Prin urmare, la un pH fiziologic de 7,25, fosfolipidele membranelor de eritrocite se găsesc atât sub formă de forme neionizate, cât și sub formă ionizată. Cu alte cuvinte, sub forma unui acid slab și a sării sale. Raportul dintre concentrațiile de sare și de acid slab este de aproximativ (1,5-4). 1. Prin urmare, membrana eritrocitului are un efect tampon, menținând un pH constant al mediului intern al celulelor roșii din sânge.
Astfel, în menținerea constanței echilibrului acido-bazic în sânge, sunt implicate un număr de sisteme tampon, care asigură acido-bazic homeostazia în organism.
În practica clinică modernă, echilibrul acido-bazic (KChR) al organismului este de obicei determinat prin testarea sângelui utilizând micrometodul Astrope și exprimat în unități de BE (din latină "bi-kurtosis" - exces de baze). Cu o stare normală a acidului-bază a organismului, BE = 0 (în aparatul Astrup acest pH corespunde la pH 7,4).
Când BE valori de la 0 la ± 3 KHS organism este considerat normal atunci când VE = ± (6 - 9) - alarmare când VE = ± (10 - 14) - în pericol și atunci când valoarea absolută a VE mai mare de 14, - critică.
Pentru a corecta KCHR la BE<0 (ацидоз) чаще используют 4%-ный раствор гидрокарбонаната натрия, который вводят внутривенно. Необходимый объем этого раствора в мл рассчитывают по эмпирической формуле v = 0,5mВЕ, где m – масса тела, кг.
Dacă statul a apărut acidoză rezultată stop cardiac tranzitorie, cantitatea de soluție NaHCO3 4% (v ml) necesară pentru a compensa deplasarea în regiunea acidă RAD, se calculează cu formula v = m z, în care z - durata de stop cardiac, min.
Corecția KSCH în alcaloză este mai complexă și necesită luarea în considerare a multor circumstanțe care pot apărea. Ca una dintre măsurile temporare, se recomandă administrarea a 5 până la 15 ml soluție 5% de acid ascorbic.
Metoda acidimetrie într-un exemplu de realizare (alkalimetry) permite determinarea cantităților de acizi și substanțe formatoare de acid (săruri formate dintr-un cation și un anion al unei baze slabe și acid tare m. P.) Folosind soluții alcaline concentrație cunoscută, numită de lucru. Într-o altă formă de realizare (atsidimetriya), această metodă permite determinarea numărului de baze și substanțe cu caracter bazic (oxizi, hidrurile și nitruri metalice, săruri de amine organice formate din cationi de baze tari și anioni ai acizilor slabi, și așa mai departe. N.) Cu acizii soluții de lucru.
Metoda de titrare bazată pe aciditate este utilizată în practica clinică, medico-legală, sanitară și igienică, precum și în evaluarea calității medicamentelor.
1 Conform teoriei protonilor, un acid este orice substanță a cărei particule moleculare (inclusiv ioni) sunt capabile să renunțe la un proton, adică fi un donator de protoni; baza se numește orice substanță a cărei particule moleculare (inclusiv ioni) sunt capabile să atașeze protoni, adică fi acceptorul protonilor.
Sisteme și soluții tampon cu bază acidă
Informații despre lucrarea "Sisteme și soluții tampon acide-bază"
boli profesionale [27]. 5.1.1 Cerința de siguranță în laboratorul agrochimic Probele de sol sunt analizate pentru starea acido-bazică în laboratorul agrochimic. Pentru a lucra în laboratorul agrochimic sunt permise persoanelor care nu au contraindicații medicale și care au fost supuse unui examen medical (la admitere la locul de muncă și periodic în curs de desfășurare). Nu.
ioni) și conservarea în masă (cantitatea de materie dintr-o soluție dată rămâne constantă dacă nu este adăugată sau produsă, îndepărtată sau distrusă). În mod normal, există un echilibru în plasmă între cationi (Na +, K +, Ca ++, Mg ++) și anioni (Cl-, HCO3-, proteine, anioni reziduali). Este egal cu 153 mmol / l și este reprezentat în diagrama Gamble. Atunci când bazele tampon bicarbonat sunt epuizate.
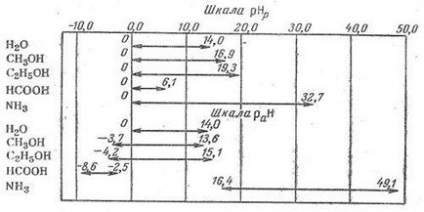
R - Acid CH H2O + N + H3 + -NH2 BH Baza de conjugat (bază-proteină G) (baza de proteine) 3.2.Opredelenie pH soluții tampon standard, utilizate ca standarde pentru măsurarea soluțiilor administrate lung. Una dintre primele soluțiile standard folosite „tampon“ Weibel, este o soluție.