Astfel, în orice atom și deci în orice moleculă, trebuie să existe mici particule electrice. Dar de ce sunt corpurile din jur departe de a le detecta întotdeauna sarcina? Acest lucru poate fi explicat foarte simplu. sarcini electrice ale atomilor nu au un efect, deoarece taxa pozitiv în atomul este exact RA-vene negativ, iar ambele taxe deja de acțiune, la o distanță scurtă de atomul anulează - taxele se anulează reciproc. Cu toate acestea, în unele cazuri, de exemplu, prin dizolvare, cu încălzire, atomii pot salva sau atașa una sau mai multe particule electrice și transformate în fragmente încărcate - ioni.
Acum vom încerca să aflăm care particule electrice pot pierde sau dobândi un atom - pozitiv sau negativ. Pentru a rezolva această problemă, trebuie să aflăm cum se află încărcăturile atomului, cum este construit atomul în sine.
În prima secțiune a cărții noastre, am rezolvat deja problema distribuirii taxelor ascunse într-o cutie de carton. Aceeași sarcină este, în esență, înaintea noastră acum. Diferența este doar la scară. Atomii au o mărime de câteva sute de milionimi dintr-un centimetru. Asta înseamnă că, și încărcările intra-atomice, sunt plasate una de cealaltă la o distanță de un centimetru, ca într-o cutie, prezentată în figura 2, dar o sută de milioane de ori mai aproape. Aproximativ la o asemenea distanță și trebuie să te apropii de atom cu o sarcină de testare. Și sarcina de testare însăși nu ar trebui să fie mai grea decât un atom, altfel va fi prea nepoliticoasă - nu va fi deplasată de forțele electrice ale atomului. A face o astfel de acuzație este dincolo de puterea artei umane, dar, din fericire, natura însăși a venit la salvare aici. Sondele de test ne-au furnizat substanțe radioactive. Particulele alfa emise de aceste substanțe s-au dovedit a fi potrivite pentru "cercetarea" încărcărilor intra-atomice. Particulele alfa sunt destul de mici și ușoare. Viteza lor este enormă: particulele alfa zboară cu o viteză de 20 kilometri pe secundă. Particulele alfa au o încărcătură electrică pozitivă. Astfel, ele sunt destul de potrivite pentru studierea structurii unui atom.
Dar cum să conduci experimentul? Nu puteți vedea atomii individuali și particulele alfa chiar și în cel mai puternic microscop. Dar trebuie să ne uităm în interiorul atomului și să învățăm din comportamentul particulelor alfa cum sunt amplasate încărcăturile în atom.
În primul rând, a fost necesar să găsim o cale de urmărire a căilor particulelor alfa. Asta a fost făcut. Există o substanță - zincul de sulf - care are o proprietate interesantă: dacă o dă o particulă alfa, luminează - dă un scurt clip. Prin bliț, puteți afla unde a cedat particula alfa dintr-o particulă de substanță radioactivă, și știind acest loc, vă puteți da seama în mod evident pe ce cale călătoresc, deși a rămas invizibil în timpul zborului.
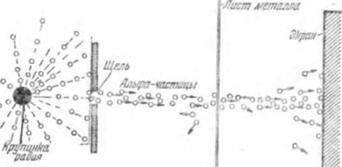
Apoi a fost necesar să se găsească o țintă adecvată pentru particulele alfa. O astfel de țintă era o foaie foarte subțire de metal, o grosime de o mie de milimetri.
Configurația pentru experiment a fost asamblată așa cum este arătat schematic în Fig. 4. Punctul negru mare spre stânga este o fracțiune a elementului radioactiv al radiului. Din acesta în toate direcțiile, un flux continuu de particule alfa zboară. Un slot tăiat pe o placă groasă de metal trece o "rază" îngustă de particule alfa. Ea dă o țesătură subțire de metal. Și în spatele foii este un ecran acoperit cu sulfură de zinc.
Și se dovedește că o foaie subțire de metal - nu un obstacol pentru zbor cu o viteză mare de particule alfa. Ei trec prin frunze și, care cad în mijlocul ecranului, dau o strălucire strălucitoare. Aceasta a condus oamenii de știință la ideea că atomul nu este deloc o particulă solidă de materie, ci constă din părți separate, separate de un spațiu gol prin care particulele alfa pot zbura liber.
Dar unele particule alfa se comportă diferit. Se abate de la calea directă. Acest lucru este evident din faptul că, în alte locuri, de asemenea, clipea înainte și înapoi de la scântei sensibile - urme de lovituri particule alfa, schimbarea direcției sale-Shih. Majoritatea particulelor schimba doar ușor direcția zborului, dar există și cele care se abate puternic, iar altele se întorc înapoi. Cum pot explica asta?
Particula alfa este încărcată pozitiv. Deci, de la clonele poate fi doar o sarcină pozitivă într-un atom, sau o parte destul de încărcat pozitiv al atomului, mai severă decât particula alfa în sine. Această parte a atomului este numită nucleu. Dacă o particulă alfa lovește nucleul direct, cu un "cap-on", atunci poate fi aruncat înapoi. Întrucât există puține astfel de particule în experiența noastră, concluzionăm că intrarea în nucleu este un caz rar. Și aceasta arată că dimensiunile miezului sunt foarte mici.
Să ne imaginăm acum particule alfa trec prin foaia de metal este clar: particulele nu au fost supuse devierea de la un traseu rectiliniu, a trecut departe de nucleele atomice. Particulele care s-au abătut pe o parte au trecut la distanțe scurte de nuclee și foarte puține particule au căzut direct în nucleu și au fost aruncate înapoi.
Astfel, experimentul cu bombardarea atomului cu particule alfa ne dovedește că încărcăturile pozitive ale atomului sunt concentrate într-un mic nucleu greu. Și sunt negative? Ei nu se simt în această experiență. Ei nu acționează complet asupra particulelor alfa, nu pot să le atragă singuri. Și suntem lăsați să tragem concluzia că sarcinile negative sub formă de particule minuscule de lumină sunt distribuite în jurul nucleului. Aceste particule mici de electricitate negativă se numesc electroni.
Cum ar trebui să ne imaginăm acum structura atomului? - În centrul atomului este nucleul. Conține toate încărcările pozitive ale atomului și aproape toată masa lui (Figura 5). Și în jurul nucleului sunt localizați electroni.
Electronii formează coaja unui atom, care este ușor pătruns de particule alfa. Pe această bază, putem presupune că este electronii, ca mai ușoare și, astfel, mult mai mobil, slab legat la atomul și se poate deplasa de la un atom la altul.
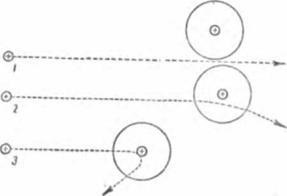
Fig. 5. Particulele alfa întâlnesc pe cale atomii de metal. Numerele 7, 2 și 3 denotă particule alfa; cercurile mari sunt atomi, în centrul lor sunt nuclee încărcate pozitiv.
Experimentele sunt confirmate pe deplin. Sa dovedit că mulți atomi, de exemplu atomi de metal, își pierd cu ușurință unii dintre electronii lor. Acest lucru se întâmplă și în timpul încălzirii și sub iluminare și sub acțiunea acelorași particule alfa. Alți atomi, dimpotrivă, sunt mai înclinați să atragă electroni în plus în cochilie. Atât deschiderea, cât și atașarea electronilor la un atom se numesc ionizări (deoarece atomul este transformat într-un ion în acest caz).
Acum, putem răspunde la întrebarea cum de la molecula de acid clorhidric, când este dizolvată, se obțin un ion pozitiv de hidrogen și un ion de clor negativ. Atomul de hidrogen dă electronul atomului de clor și, prin urmare, în carcasa atomului de clor există un exces de încărcări negative (în comparație cu cantitatea de încărcări pozitive din nucleu), iar atomul de hidrogen devine un ion încărcat pozitiv. Deoarece atomul de hidrogen a dat un singur electron și atomul de clor a primit acest electron, este evident că încărcătura ionilor obținuți este egală cu sarcina electronului.