După cum se știe, ischemia cerebrală are ca rezultat scăderea bruscă a nivelului fluxului sanguin cerebral sau oprirea completă a acestuia. Deteriorarea cerebrală ischemică este una dintre cele mai frecvente componente ale afecțiunii post-traumatice a creierului.
J. Garsia și colab. stresul ca ischemia creierului este globala sau focala. La rândul său, ischemia globală poate fi ireversibilă, în creștere și tranzitorie (tranzitorie).
Deci, ischemia cerebrală globală și ireversibilă este caracteristică stării postmortem a creierului. Creșterea ischemiei globale se observă în starea agonistă. Ca urmare a acestor două tipuri de ischemie globală, se dezvoltă procese autolitice în țesutul cerebral.
Ischemia cerebrală globală tranzitorie (tranzitorie) include condițiile observate, de exemplu, în moartea clinică sau în alte cazuri în care circulația cardiacă este restabilită după un stop cardiac temporar. Astfel, ischemia globală tranzitorie a creierului poate să apară în cazurile de CCT, însoțită de o scădere bruscă a tensiunii arteriale. Asfixierea pe termen scurt este, de asemenea, o condiție pentru dezvoltarea ischemiei globale tranzitorii a creierului.
În funcție de durata ischemiei globale, procesele distrofice, necrobiotice până la moartea creierului se pot manifesta în substanța creierului în diferite grade de gravitate. Caracteristica microscopică a morții cerebrale este absența colorării nucleare, în principal a neuronilor, a colorării slabe a mantalei de mielină și a absenței unei reacții inflamatorii, blanșarea eritrocitelor.
Cele mai timpurii leziuni ale creierului sunt observate în zonele de hipersensibilitate la ischemie. După cum știți, în creier există zone în care daunele se dezvoltă în primul rând în ischemia globală. De regulă, aceste modificări se regăsesc în zona comună a ramurilor terminale ale arterelor, în așa-numitele zone de alimentare cu sânge adiacente. Viteza fluxului sanguin în aceste zone este mult mai mică decât în restul creierului. Prin urmare, chiar și o oprire scurtă a fluxului sanguin conduce la formarea stazei și a eritrocitelor de nămol cu formarea ulterioară a unui tromb în aceste vase.
După cum sa menționat deja mai sus, celulele hipocampale și celulele Purkinje ale cerebelului sunt hipersensibile la ischemia globală.
Există o diferență de sensibilitate la ischemie, chiar și între diferite straturi de celule corticale. Astfel, celulele straturilor III, IV și V ale cortexului emisferelor cerebrale sunt mai sensibile la ischemie decât celulele straturilor I, II și VI.
În aceleași condiții de ischemie, neuronii ca întreg sunt mai sensibili decât oligodendrogliocitele și chiar mai mult decât astrocitele.
Ischemia cerebrală focală este o consecință a tulburărilor circulatorii în zona de alimentare cu sânge a uneia sau mai multor artere. Ocluzia arterei, arteriolelor sau venelor duce la ischemie cerebrală focală prelungită și la dezvoltarea unui focar de necroză a coagulării.
Adesea, cauza ischemiei cerebrale focale este un spasm al unei, două sau chiar mai multe artere din cercul vilizian (Figurile 5-57, 5-58). Astfel, un atac de cord în zona de vascularizare a arterei bazilare se găsește la 41,6% dintre pacienții cu dopplerografie diagnosticată de spasm arterial bazilar.
Potrivit lui Doppler, vasospasmul posttraumatic începe 2-5 zile după leziune și poate surprinde una, două sau chiar toate arterele cercului Willis. Se remarcă faptul că spasmul arterelor cerebrale după ce se dezvoltă CCT mai devreme decât vasospasmul după ruptura anevrismului. Motivul pentru această diferență temporară nu este încă cunoscut.
Pentru ischemia focală a creierului duce la tromboza vaselor de sânge. Cauza Tromboza poate fi: 1) hipotensiune arterială bruscă, ducând la stază și sladzhfenomenu eritrocite, de preferință la locurile de fluxul sanguin lent (terminal ramură în zonele de circulație adiacente); 2) deteriorarea mecanică a peretelui vasului; 3) creșterea coagulabilității sângelui; 4) Sindromul DIC.
Edemul pereților arteriolari, datorită leziunii sau hemoragiei intramurale, un lumen îngust sau obturat poate fi cauza ischemiei cerebrale. Ocluzia lumenului venular, edemul perivascular (edemul picioarelor astrocitelor) sau hemoragia pervasculară contribuie, de asemenea, la slăbirea.
Ocluzia zonelor periferice ale arterelor cerebrale care provoacă deficit de focal al circulației sanguine și simptome neurologice focale, care dispar rapid dacă ischemia focală compensată de garanții reale în mai puțin de 1-2 ore.
Deficitul neurologic inițial reflectă afectarea subletală a neuronilor din regiunea creierului, care este complet sau parțial întreruptă de aprovizionarea cu sânge a arterei ocluzate. Deficitele neurologice și, în consecință, deteriorarea neuronilor devin ireversibile. Dacă ischemia cerebrală durează mai mult de 60-120 de minute, se produce un infarct cerebral în zona de vascularizare corespunzătoare a vasului ocluzat.
Caracteristică macroscopică a infarctului cerebral.
Limita dintre un infarct ischemic proaspăt și o zonă periferică a creierului este de obicei dificil de identificat direct în autopsie. La cercetarea macroscopică a autopsiei, centrul unui infarct ischemic de prescripție zilnică nu are limite clare cu zona perifocală. Edemul emisferei corespondente și, poate, o consistență oarecum mai puțin falsă a substanței creierului în partea centrală a focusului ischemic permite să se suspecteze un infarct cerebral. 2-3 zile mai târziu, încep să apară limitele țesutului ischemic. Edemul perifocal dispare de obicei după două săptămâni.
Infarcturile ischemice formează cea mai mare parte a infarcturilor cerebrale, se pot dezvolta în orice parte a creierului și pot fi de diferite mărimi (Figura 5-59).
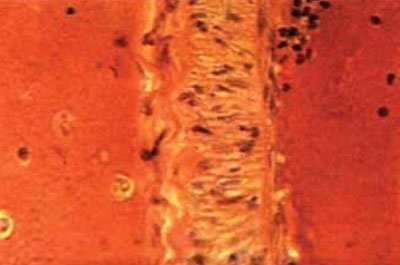
Fig. 5.57. Spasmul arterei cercului Willis, înfășurat într-un sânge convoluționat: contururi sinuoase ale membranei elastice, fragmentarea parțială a acesteia; edem perinuclear în celulele musculare netede, x200 (hematoxilină-eozină).
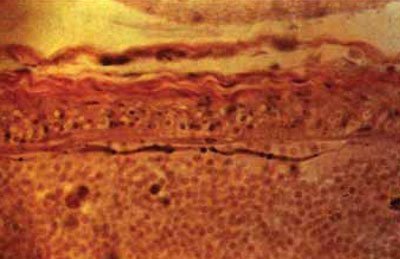
Fig. 5.58. Artery Spasm cercul lui Willis: strat exfolierii adventitial, umflarea pernuklearny densitate diferită și colorarea citoplasmei celulelor musculare netede, fragmentare, contururile sinuoase ale membranei elastice, X200 (hematoxilină-eozină).
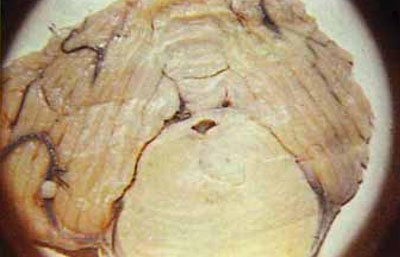
Fig. 5.59. Secțiunea frontală la nivelul treimii anterioare a podului. Accentul unui atac de cord ischemic al podului, dezvoltat în cazul unei vânătăi a lobului temporal.
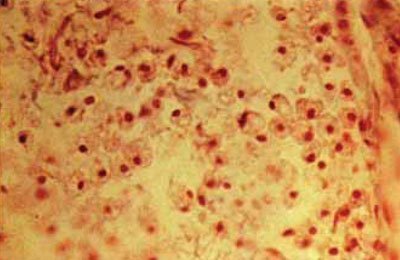
Fig. 5.61. "Bile granulare" - macrofage în locusul infarctului cerebral lacunar, x300 (culoare conform Mallory).
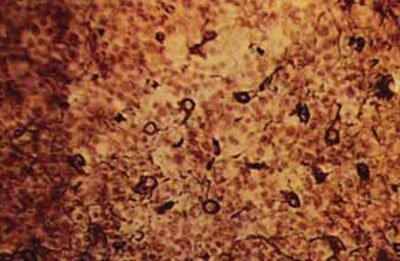
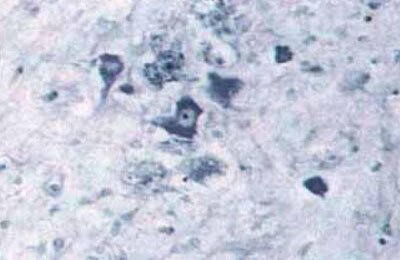
Fig. 5.63. Necroza neuronilor din zonele periferice ale infarctului cerebral. Umflarea, vacuolizarea, liza citoplasmei neuronilor, distrugerea nucleului, x200 (culoarea conform Nissla).
Infarcturile hemoragice, de obicei de dimensiuni mici, se dezvoltă în materie cenușie. Cauza apariției lor poate fi ocluzia, atât arterele cât și venele. Din punct de vedere macroscopic, infarctul hemoragic este un focar de consistență falsă a culorii roșii cu limite clare (spre deosebire de hemoragiile hemoragice hemoragice). Claritatea limitelor se datorează faptului că hemoragia este precedată de procesele necrobiotice din substanța creierului. Cu toate acestea, ambele procese sunt similare în timp, spre deosebire de infarctul mixt.
Un atac de cord mixt este un infarct ischemic cu focare de hemoragie a diferitelor prescripții, ceea ce îi conferă un aspect strălucit. Cel mai adesea apar în emisferele cerebrale, ajungând adesea la dimensiuni mari.
Implanturile lacunare sunt rezultatul ocluziei arterelor mici penetrante. Se dezvoltă în ganglionii bazali, în capsula interioară, în perna podului, în materia alb subcorticală. Mărimea lacunelor, de obicei, nu depășește diametrul de 15-36 mm și depinde de calibrul vasului ocluzat (Figurile 5-60). Infarcturile lacunare proaspete sunt greu de distins și pot rămâne neobservate în secțiunile creierului produse direct în timpul autopsiei.
Caracteristicile microscopice ale infarctelor cerebrale.
Rezultatele intracraniene experimentale de ocluzie a arterelor intr-un pestriț focal ischemie-spălare, care se scurge după 2-3 ore într-o porțiune ridicată „atac de cord“, a creierului.
Modificările în structurile creierului cauzate de ocluzia arterei cresc treptat. Pe baza preparatelor histologice colorate cu hematoxilină și eozină, primele semne de leziuni neuronale sunt descoperite după 2-3 ore. La trei ore după ocluzia arterei sunt identificate trei zone ale infarctului - central, reactiv și perifocal. Procesele necrobiotice în neuroni cresc în primele 18-24 de ore.
După cum arată studiile experimentale, debutul morții primului grup de neuroni în zona ischemică coincide cu debutul dezintegrării în oligodendrocite. Astrocitele, în contrast cu neuronii care suferă modificări degenerative, în primele 4-6 ore de la debutul ischemiei, în acest interval de timp prezintă chiar semne de activare. La 8-12 ore după ocluzia arterei, se descoperă o colorare slabă a tecii de mielină. Dezintegrarea tecii de mielină are loc în 2-3 zile. Necroza celulelor endoteliale este vizibilă în mod clar încă 2 zile după ocluzia vasului. Starea marginală a neutrofilelor în capilare și venule poate fi detectată încă la 12 ore de la debutul ischemiei. Introducerea neutrofilelor în zona de necroză a creierului începe în 24-36 de ore. În acest moment apar monocite, care după 5-7 zile se transformă în macrofage (Figura 5-61) și vasele nou formate cresc în centrul infarctului (Figura 5-62).
Cu toate acestea, în lucrările clasice Neuromorphology care indică faptul că 4-8 săptămâni după traumatism cranian în ipsilateral cortexul nu numai, dar, de asemenea, emisferele contralateral ale creierului se găsesc așa-numitele „modificări ischemice“ in neuroni (neuroni roșii). Se crede că aceste schimbări ale neuronilor și distrugerea lor ulterioară, sunt rezultatul hipoxiei cerebrale prelungite.
Într-adevăr, dovada histologica de deteriorare hipoxic a neuronilor din hipocampus si alte regiuni ale creierului au fost găsite în 93% din cazuri de leziuni cerebrale traumatice cu hipoxemie documentate. Studiul morfologiei rănirii experimentale cerebrale traumatice, de asemenea, a arătat că în timpul primei săptămâni după leziuni cerebrale, există o moarte neuronală intarziata in aprovizionarea cu sange adiacente zonei, hipocampus și talamus.
Astfel, în 84% din autopsiile cazurilor letale de traumatism craniocebral închis, a fost detectată "pierderea" neuronilor sau deteriorarea gravă a neuronilor din zona C-A-1 a hipocampului. Dintre acestea, leziunile neuronilor au fost de asemenea detectate în 44% din regiunea C-A-3 a hipocampului, care nu are o sensibilitate selectivă la hipoxie.
Rezumând rezultatele unei serii de studii, M. Kotapka și colab. a ajuns la concluzia că hipoxia-hipoxemie, provocată de diverse cauze, cum ar fi tulburările funcției respiratorii, hipotensiunea arterială, expunerea la exotoxine, tulburările de circulație cerebrală etc. afectează numai parțial moartea selectivă a neuronilor hipocampali după TCC. Astfel de observații au arătat că, probabil, există și alte mecanisme de afectare neuronală, pe lângă hipoxia-ischemie.
La mijlocul anilor 1990, A. Rink și colab. sa demonstrat că motivul pentru moartea întârziată a neuronilor, cel puțin în modelele TBI experimentale, este apoptoza acestor celule.
Termenul de "apoptoză" (frunze care se încadrează), mulți cercetători folosesc ca sinonim pentru conceptul de "moarte celulară programată", în timp ce acești termeni înseamnă procese similare, dar nu identice.
moartea celulară programată genetic este o parte importanta a proceselor corpului involutive (de exemplu, vârstă atrofie timus) actualizarea populația celulelor hematopoietice, epiteliul tractului gastrointestinal și tractului respirator, etc. și este rezultatul activării programului genetic al morții, respectiv, „ceasul biologic“ al fiecărei celule în parte.
Apoptoza este moartea unei celule induse din exterior, i. E. "Suicide, sinucidere". În aceste cazuri, moartea celulară începe cu fragmentarea ADN, adică distrugerea nucleului său.
Necroza celulelor este un proces pasiv, rezultatul său „ucidere“ extern la factorii de celule. necroza moartea celulelor începe și se termină cu fragmentarea ADN-ului citoplasmatic. Caracteristicile morfologice celulei necroză este umflarea, opărire, creșterea volumului de citoplasmă, liza organite, distrugerea membranei celulare (fig. 5-63).
Caracteristicile morfologice ale apoptozei includ condensarea cromatinei (fig. 5-64), descompunerea nucleului pentru a forma corpilor apoptotici (karyorrhexis) exprimate intranucleare fragmentarea ADN, eozinofilie și reducerea volumului citoplasmei, în care o lungă perioadă de timp să rămână intacte organite.
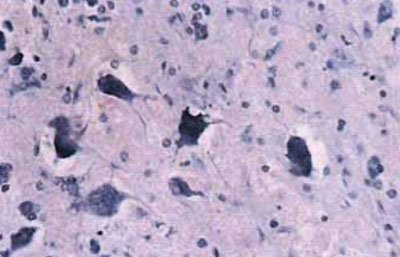
Fig. 5.64. Hyperchromia si reducerea citoplasmei zona picnoza neuronilor nucleului in emisfera hipocampus kontlateralnogo prejudiciu vatra, x200 (pe Nissl pata).
Capacitatea de a repara complet ADN-ul este o condiție pentru menținerea funcționării normale a neuronului. În cazurile de mutație a genei cromozomiale, se poate crește posibilitatea ca repararea ADN-ului să se înrăutățească. Protecția defectuoasă a ADN-ului, care a condus la instabilitatea genomului, poate fi motivul mecanismelor de declanșare a apoptozei.
Aceste date dobândesc deja o importanță practică. Măsurile terapeutice utilizate în prezent în clinicile neurologice vizează în primul rând prevenirea necrozei ischemice de coagulare și nu iau în considerare posibilitatea decesului neuronal datorat apoptozei. Întrucât suplimentarea tratamentului cu medicamente care reduc riscul de apoptoză poate deschide noi oportunități în prevenirea sau reducerea leziunilor cerebrale post-traumatice.