Luăm substanța sub formă de lichid și vaporii saturați în echilibru cu ea și, fără a schimba volumul, începem să luăm căldură din ea. Acest proces va fi însoțit de o scădere a temperaturii substanței și o scădere corespunzătoare a presiunii. Prin urmare, punctul reprezentând starea materiei din diagramă (p, T) se deplasează în jos de-a lungul curbei de evaporare (figura 47a). Aceasta continuă până când temperatura de cristalizare a substanței care corespunde valorii de echilibru a presiunii este atinsă. Denumim această temperatură de către Tm. Tot timpul, în timpul procesului de cristalizare, temperatura și presiunea rămân neschimbate. Căldura dată este căldura eliberată în timpul cristalizării.
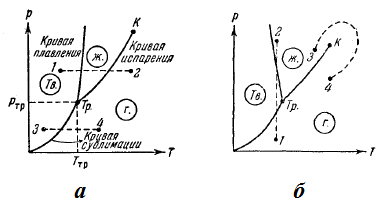
Fig. 47. Diagrame de stare
Temperatura Tmr și presiunea corespunzătoare de echilibru pmr sunt singurele valori ale temperaturii și ale presiunii la care trei faze ale substanței pot fi în echilibru: solid, lichid și gazos. Punctul corespunzător din diagramă (p, T) se numește triple. Astfel, punctul triplu determină condițiile în care trei faze ale materiei pot fi simultan în echilibru.
La sfârșitul procesului de cristalizare, fazele solide și gazoase vor fi în echilibru. Dacă vom continua să scoatem căldura din substanță, atunci temperatura va începe din nou să scadă. În consecință, presiunea de vapori în echilibru cu faza cristalină scade. Punctul care descrie starea materiei se deplasează în jos pe curba de sublimare.
Temperatura punctului triplu este temperatura la care substanța se topește, fiind sub presiune egală cu ppm. La alte presiuni, punctul de topire va fi diferit. Relația dintre presiunea și temperatura de topire este arătată de curba de topire pornind de la punctul triplu. Astfel, punctul triplu este situată la intersecția celor trei curbe, care definesc condițiile de echilibru ale celor două faze, solide și lichide, lichide sau gazoase, și în final solidă și gazoasă.
În funcție de raportul dintre volumele specifice ale fazelor solide și lichide, curba de topire se realizează fie ca în fig. 47a. fie ca în Fig. 47b.
Curbele de topire, evaporare și sublimare împart planul coordonatelor în trei regiuni. La stânga și sublimare de topire curbe constă regiunea fazei solide, între curbele și zona de evaporare de topire este cuprins stări lichide, și în final la dreapta evaporării curbelor și regiunea de sublimare se extinde stări gazoase ale substanței. Orice punct într-una din aceste zone reprezintă o stare corespunzătoare cu o singură fază a materiei (tot timpul avem în vedere numai starea de echilibru, adică. E., o astfel de stare în care contează la fel de mult sejururi atâta timp la un condiții externe constante). Orice punct situat pe una dintre curbele delimitate de limită reprezintă starea de echilibru a celor două faze corespunzătoare ale substanței. Punctul triplu reprezintă starea de echilibru a tuturor celor trei faze.
Astfel, fiecare punct din diagramă reprezintă o anumită stare de echilibru a substanței. Prin urmare, se numește o diagramă de stare.
Diagrama de faze construită pe baza datelor experimentale permite evaluarea în ce stare se află substanța dată la anumite p și T și, de asemenea, ce tranziții de fază vor apărea într-un anumit proces. (. Figura 47a) De exemplu, în condiții corespunzătoare punctului 1, substanța este în stare solidă, la 2 - în gazul, și în orice punct de pe curba de topire - atât în stări lichide și solide. Presupunem că solidul în stare solidă corespunzător punctului 1 este supus încălzirii izobatice, așa cum este reprezentat în diagrama de stare a liniei punctate orizontal 1 - 2. Figura arată că, la temperatura care corespunde intersecției liniei punctate cu curba de topire, substanța se topește la o temperatură mai ridicată corespunde intersecției cu 1-2 curba evaporare drept începe să se transforme în gaz. Dacă substanța este într-o stare solidă corespunzătoare punctului 3, atunci în încălzirea izobarică (linia întreruptă 3-4), cristalul este transformat în gaz, ocolind faza lichidă. Dacă diagrama de fază are forma prezentată în Fig. 47b. apoi sub compresie izotermică de la starea 1 la starea 2, substanța din faza gazoasă va trece într-un solid și apoi într-un lichid.
Curba de evaporare se termină la punctul critic K. Prin urmare, este posibilă o tranziție continuă a materiei de la starea lichidului la starea gazoasă și înapoi la punctul critic. fără a trece curba de evaporare (tranziție 3-4 din Fig. 47b), t. e. o tranziție care nu este însoțită de transformări de fază. Acest lucru este posibil deoarece diferența între gaz și lichidul este pur cantitativ (ambele aceste stări, de exemplu, sunt izotrop). Tranziția stării cristaline (anizotropie caracterizat) în gaz lichid sau poate fi doar abrupt (ca rezultat al tranziției de fază), astfel încât curbele de topire și sublimare nu pot fi discontinue, așa cum este cazul pentru curba de evaporare la punctul critic. Topirea curba se duce la infinit, iar curba este un punct de sublimare, unde p = 0 și T = 0.