Lichid uleios volatil lichid, t ° pl. = 17 ° C; t ° b. = 66 ° C; în aer "fumează", absoarbe foarte mult umiditatea (depozitată în vase sigilate).
SO 3 este ușor solubil în acid sulfuric 100%, această soluție se numește oleum.
1) Anhidrida sulfurică este un oxid acid.
Interacțiunea cu apa
Când se dizolvă în apă, se obține un acid sulfuric dibazic puternic:
Disocierea continuă:
H 2 SO 4 → H + + HSO 4 - (prima etapă se formează ionul sulfat de hidrogen)
HSO 4 - → H + + SO 4 2- (etapa a doua, se formează ionul sulfat)
H 2 SO 4 formează două serii de săruri - mediu (sulfați) și acid (hidrosulfați)
Interacțiunea cu alcalii
NaOH + S03 (exces) → NaHS04
Interacțiunea cu oxizii de bază
Proprietățile fizice ale acidului sulfuric:
Lichid uleios greu ("ulei vitriolic");
densitate de 1,84 g / cm3; non-volatile, foarte solubile în apă - cu căldură puternică; t ° pl. = 10,3 ° C, t ° b. = 296 ° C, foarte higroscopic, are proprietăți de îndepărtare a apei (hârtie de hârtie, lemn, zahăr).
Căldura de hidratare este atât de mare încât amestecul poate fi fierb, stropi și provoacă arsuri. Prin urmare, este necesar să se adauge acidul în apă, dar nu și invers, deoarece adăugarea de apă la o apă acidă ar fi mai ușor pentru suprafața de acid în cazul în care se concentrează toată căldura eliberată.
Producția industrială de acid sulfuric (metoda de contact):
Pirita umedă, purificată, umedă (pirită de sulf) este turnată de sus în cuptorul de coacere în "patul fluidizat". În partea de jos (principiul contra-fluxului) permiteți trecerea aerului îmbogățit cu oxigen.
Din cuptor vine gazul de cuptor, compoziția din care: SO2. O2. o pereche de apă (pirita a fost umedă) și cele mai mici particule de ciment (oxid de fier). Gazul este curățat de impurități de particule solide (într-un ciclon și un precipitator electrostatic) și de vapori de apă (într-un turn de uscare).
Aparatul de contact oxidează gazul de dioxid de sulf utilizând un catalizator V205 (pentoxid de vanadiu) pentru a crește viteza de reacție. Procesul de oxidare a unui oxid la altul este reversibil. Prin urmare, condițiile optime sunt selectate flux de reacție directă - presiune ridicată (deoarece reacția are loc direct cu reducerea volumului total) și temperatura nu este peste 500 C (deoarece reacția este exotermă).
În turnul de absorbție, oxidul de sulf (VI) este absorbit de acidul sulfuric concentrat.
absorbție a apei nu este utilizat, deoarece oxidul de sulf se dizolvă în apă pentru a elibera cantități mari de căldură, astfel încât acidul sulfuric format fierbe și se transformă în abur. Pentru a preveni formarea de ceață de acid sulfuric, se utilizează 98% acid sulfuric concentrat. Oxidul de sulf se dizolvă foarte bine într-un astfel de acid, formând un oleum: H2SO4 · nSO3
Proprietăți chimice ale acidului sulfuric:
H2 SO4 - acidul dibazic puternic, unul dintre cei mai puternici acizi minerali, datorită legăturii de înaltă polaritate H - O ușor de rupt.
1) În soluție apoasă, acidul sulfuric disociază. formarea unui ion de hidrogen și a unui reziduu acid:
H2S04 = H + + HSO4-;
HSO4 - = H + + S04 2-.
Ecuația totală:
H2S04 = 2H + + S04-.
2) Interacțiunea acidului sulfuric cu metale:
Acidul sulfuric diluat dizolvă numai metalele care se află într-un șir de tulpini din stânga hidrogenului:
Zn 0 + H2 + SO4 (dec) → Zn + 2S04 + H2
5) Schimbarea reacțiilor cu săruri:
BaCl2 + H2S04 → BaS04 + 2HCI
Formarea de precipitat alb BaSO4 (insolubilă în acid) utilizat pentru detectarea acidului sulfuric și sulfații solubili (reacție de calitate pentru ion sulfat).
Proprietăți speciale ale H2SO4 concentrat:
1) Acidul sulfuric concentrat este un oxidant puternic; când interacționează cu metalele (cu excepția Au, Pt), recuperează la S +4 O2. S 0 sau H2 S -2 în funcție de activitatea metalului. Fără încălzire nu reacționează cu Fe, Al, Cr - pasivarea. Atunci când interacționează cu metale care au o valență variabilă, acestea sunt oxidate în stări de oxidare mai mari. decât în cazul unei soluții de acid diluat: Fe 0 → Fe 3+. Cr 0 → Cr 3+. Mn 0 → Mn 4+, Sn 0 → Sn 4+
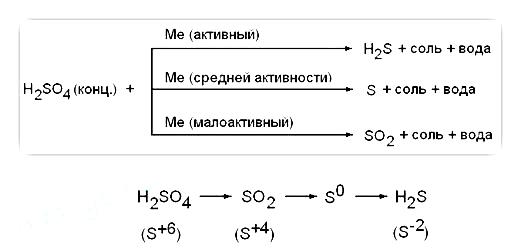
Activitate metalică medie
2) Acidul sulfuric concentrat oxidează, de regulă, unele nemetale la gradul maxim de oxidare, el însuși este redus la S + 4O2:
3) Oxidarea substanțelor complexe:
Acidul sulfuric oxidează HI și HBr la halogeni liberi:
2 KBr + 2H2S04 = K2S04 + S02 + Br2 + 2H20
2 KI + 2H2S04 = K2S04 + S02 + I2 + 2H20
Acidul sulfuric concentrat nu poate să oxideze ionii de clor în clor liber, ceea ce face posibilă obținerea de HCI prin reacția de schimb:
NaCI + H2S04 (conc.) = NaHS04 + HCI
Acidul sulfuric îndepărtează apa legată chimic din compuși organici care conțin grupe hidroxil. Deshidratarea alcoolului etilic în prezența acidului sulfuric concentrat conduce la producerea de etilenă:
C2H5OH = C2H4 + H20.
Încărcarea zahărului, a celulozei, a amidonului și a altor carbohidrați la contactul cu acidul sulfuric se explică și prin deshidratarea acestora:
C6H12O6 + 12H2S04 = 18H2O + 12SO2 ↑ + 6CO2 ↑.