Energia totală potențială a interacțiunii particulelor este negativă la distanțe apropiate și îndepărtate (energia de atracție predomină). Ea este moleculă dff 1 micron 5 = 20 aceeași) în metanol la o intensitate a câmpului electric de 0 - 100 3 - 150 V
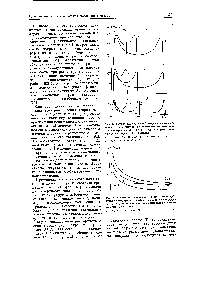
Ce se utilizează în metoda considerată Ce ne permite să efectuăm o reacție chimică reversibilă termodinamic Natura electrică a forțelor chimice este utilizată. Dar, conform uneia dintre legile fundamentale ale fizicii, în funcție de teorema asupra forței viiale, energia potențială a interacțiunii cu particule corespunde întotdeauna unei anumite energii a mișcării lor. Iar energia de mișcare a particulelor se manifestă în primul rând prin presiunea exercitată de particule pe orice barieră impermeabilă. Imaginați-vă o partiție semipermeabilă. prin care moleculele tuturor substanțelor reactive trec liber. cu excepția unei substanțe. Presiune pe un perete impermeabil, plasat în spatele unei partiții semipermeabile. va fi egală cu presiunea parțială a substanței în amestecul de reacție. Schimbarea numărului de particule ale acestei substanțe cauzate de cursul reacției. va afecta imediat valoarea presiunii parțiale Pf. În schimb, dacă w> 1, presiunea p este echilibrată din exterior. dar cu un ușor exces sau o deficiență (și în consecință, necesită compresia parțială sau expansiune), obținem posibilitatea de a regla masa materialului i-lea, m. e. afectează reacția (în apropierea condițiilor de echilibru). Aceasta a servit drept bază pentru ideea remarcabilă a lui Vant-Hoff cu privire la conduita echilibrată a reacțiilor chimice în gaze și soluții prin intermediul cilindrilor de lucru. comunicând cu vasul de reacție prin pereți despărțitori semipermeabili (Figura 31). [C.312]
Trebuie notat faptul că stabilitatea termodinamică a sistemelor de dispersie este atribuită a două stări corespunzătoare a două minime ale energiei interacțiunii potențiale a particulelor. Starea de stabilitate a sistemelor liofilice, ca sisteme de formare simulativ, corespunde primului minim potential potențial. care caracterizează fuziunea, contactul direct al particulelor cu formarea unei structuri continue a corpului. Rezistența termodinamică la coagularea sistemelor lyofobe se referă la un minim potențial superficial. care corespunde coagulării la distanțe mari între particule în timpul interacțiunii lor prin intermediul straturilor intermediare ale mediului. După cum sa menționat deja, este posibilă distilarea izotermică în astfel de sisteme. deoarece acestea sunt instabile în ceea ce privește primul minim. [C.332]
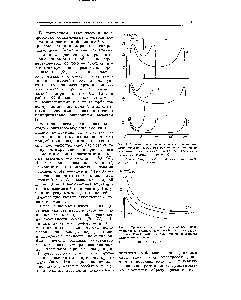
În conformitate cu teoria DLLO, relațiile (VI.109) - (VI.11) determină comportamentul sistemelor de dispersie. Stabilitatea sau rata de coagulare a acestora depinde de semnul și de valoarea energiei de interacțiune potențiale totale a particulelor. Energia pozitivă respingătoare 6 e (A) scade exponențial cu o distanță în creștere. iar energia negativă a atracției Vm (A) este invers proporțională cu pătratul distanței (Figura 1.16). Ca rezultat, la distanțe scurte (ca h O / e-const ohmi. - °°) și distanțe lungi (exponent scade mult mai rapid decât o funcție de putere) între particule este dominată de energia de atracție. și la distanțe medii - energia repulsiei electrostatice. Minimul primar I corespunde coalescenței directe a particulelor. iar minimul secundar II este atragerea lor prin stratul intermediar al mediului. Maximul corespunzător distanțelor medii caracterizează bariera potențială. prevenirea lipirii particulelor. Forțele de interacțiune se pot extinde până la distanțe de până la sute de nanometri, valoarea maximă a energiei ajunge la 10 J / m și mai mult. O creștere a barierului potențial este facilitată de creșterea potențialului pe suprafața particulelor (1.109) în regiunea valorilor sale mici. Experimentele arată că o barieră potențială apare deja la valoarea de 20 mV. asigurând stabilitatea agregativă a discuției [c.381]
Atotz este un termen care ține cont de schimbarea energiei potențiale a interacțiunii particulelor 1 în domeniul particulelor de solvenți. Condițiile de echilibru (2.38) pot fi scrise sub forma [c.42]
La distanțe suficient de mari, energia potențială a interacțiunii particulelor este foarte mică. Când se apropie Hn, particulele intră în potențialul bine. Cu o scădere suplimentară a lui H, apare o barieră potențială. prevenind abordarea particulelor. Cu cât este mai mare / bară, cu atât este mai stabilă varianța. De obicei, dispersia este stabilă la 20 kbar. Dacă în procesul de mișcare Brownian două particule au depășit o barieră potențială. atunci ei intră în [c.147]
Fig. 2. Curba energiei potențiale a interacțiunii unei particule cu cele două vecine [1]. Axa Ox corespunde volumului limitat al sistemului

Există idei destul de clare despre modul în care apare coagularea ireversibilă a anunțurilor coloidale dacă se apropie atât de încet încât energia lor cinetică poate fi neglijată în comparație cu energia w. interacțiune. Aceste reprezentări se bazează pe teorie / DLLO. În această teorie, se crede că coagularea este realizată dacă energia maximă potențială a interacțiunii particulelor este zero [c.14]
Teoria cantitativă a formării agregării la nivelul interacțiunii de contact a două particule este prezentată mai jos [17, 18]. HyisTb în momentul inițial, două particule sferice identice cu raza Ro încep să se apropie de viteza v0, distanța dintre suprafețele lor în acest moment este k0 Ro. Este necesar să găsim o legătură între parametrii vo, ro și alți parametri. la care particulele sunt capabile să depășească bariera potențială a forțelor de suprafață. ipoteze similare în teoria statică stabilitatea DLVO se presupune că energia potențială de interacțiune a particulelor U (h) are un maxim de / i = / Zk și potențial bine suficient de adânc la / g Vezi pagina unde energia potențială pe termen de interacțiune a particulelor menționate. [C.85] [c.108] [c.356] [c.285] [c.285] [c.339] [c.126] [C.16] [c.46] [C.17] [c.71] [C.8] [c.119] [C.16] [c.129] [c.207] Durabilitatea și distrugerea materialelor elastice (1964) - [C.11. C.12]