Informații generale despre Valence of Sulf
Sulful este situat în a treia perioadă a grupului VI la principalul (A) subgrup al Tabelului periodic.
La presiune normală, sulful formează cristale galbene casante care se topesc la o temperatură de 112,8 ° C Densitate 2,07 g / cm 3. insolubil în apă, dar destul de solubil în sulfură de carbon, benzen și alte lichide. Pentru evaporarea sulfului lichid din soluție sub formă de cristale galben transparent sistem ortorombic având forma octaedrii (modificarea ortorombică).
Dacă sulful topit se răcește lent și într-un moment în care este parțial întărită pentru a fuziona nu a avut încă timp să se întărească lichidul poate obține un lung cristale de culoare închisă galben aciculare ale sistemului monoclinic (modificarea monoclinic). Densitate 1,96 g / cm3. Punctul de topire este de 119,3 ° C.
Valence de sulf în compuși
Sulful este elementul al șaisprezecelea al mesei periodice. Universitatea Mendeleev. Ea se află în a treia perioadă în grupul VIA. Nucleul atomului de sulf conține 16 protoni și 16 neutroni (numărul de masă este de 32). Există trei niveluri de energie în atomul de sulf, pe care se află 16 electroni (Figura 1).
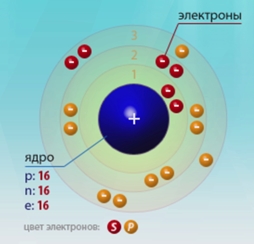
Fig. 1. Structura atomului de sulf.
Formula electronică a atomului de sulf în starea de bază are următoarea formă:
Și diagrama energiei (construită doar pentru electronii de nivelul energiei externe, care se numește valență într-un alt mod):
Prezența a doi electroni neparticipați indică faptul că sulful este capabil să manifeste valența II în compușii săi (H2S II).
prezența mai multor stări excitate de faptul că orbitalii 3d -podurovnya rămase libere (în al treilea strat, în plus față de energie și 3S- 3p-subnivele este subnivel-3d, de asemenea) este caracteristic pentru atomul de sulf. În primul rând aburit electroni 3p -podurovnya și ocupă orbitalii d libere, și după - 3s electroni -podurovnya:
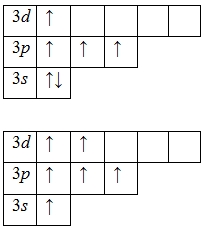
Prezența a patru și șase electroni nepereche în stare excitată indica faptul ca exponatele de sulf în lor compușilor valență IV (S IV O2. H2 S IV O3. Na2S IV O3) și VI (S VI O3. H2 S VI O4. CaS VI O4).