Principalele prevederi ale teoriei moleculare-cinetice a materiei
Să formulez tezele principale ale acestei teorii.
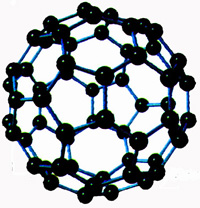
1. Toate substanțele (solide, lichide sau gazoase) constau din cele mai mici particule - molecule. care păstrează proprietățile de bază ale substanței.
Ideea teoriei moleculare a fost exprimată pentru prima oară în urmă cu mai mult de douăzeci de secole de filozoful antic grec Democritus, însă presupunerile sale ingenioase de-a lungul timpului au fost uitate de multe secole. Numai în secolul al XIII-lea a fost amintit din nou.
Este dificil de explicat logica inteleptii antice ale Anaximene, Flesa, Empidokla și Heraclit, care a spus că toată lumea din jurul nostru este construit din aer, apă, pământ sau foc.
Oarecum mai târziu, numitele "elemente materiale ale lumii" au fost înlocuite de Aristotel "insubstanțial": rece, căldură, umiditate, uscăciune.
Sindicatul asociat de elemente imateriale a dat materialul anterior. Astfel, uscat și rece a dat pământ, foc fierbinte și umed - aer, umed și rece.
Principala greșeală a lui Aristotel a fost declarația că toate substanțele pot fi împărțite la infinit și că atomii și moleculele nu există.
Numai lucrări de oameni de știință restante Gassendi, Boyle, Lavoisier, Dalton, om de știință rus Mihail Lomonosov a fost dovedit că toate substanțele constau din molecule - particule de dimensiuni foarte mici, a căror dimensiune transversală este de ordinul.
Dacă moleculele unei picături de apă sunt trase în cel mai subțire fir molecular, atunci lungimea ei este de 8 ori distanța de la Pământ la Lună. Apple este mult mai mult decât o moleculă, de câte ori Pământul este mai mare decât un măr.
2. Cele mai mici particule ale materiei sunt în mișcare aleatorie continuă, numită haotică sau termică. Nu are o direcție preferențială, iar intensitatea ei depinde de temperatură.
Mișcarea browniană a unor particule foarte mici dintr-un solid într-un lichid servește ca o dovadă a existenței unei mișcări haotice a moleculelor. Particulele browniene se mișcă în mod aleatoriu din cauza numărului continuu de molecule care le lovește din direcții diferite.
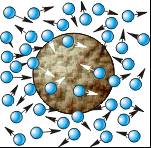
Este important de menționat că toate direcțiile vitezei mișcării sunt la fel de probabile, dar modulele de viteză respectă o lege de distribuție complet definită - legea distribuției Maxwell. În acest caz, majoritatea moleculelor sunt grupate în jurul anumitor valori ale vitezelor, care depind de masa moleculelor și de temperatură.
3. Particulele de materie interacționează între ele. În același timp, pe fiecare moleculă 2, forțele de atracție și repulsie acționează pe partea moleculei vecine 1 (figura 1). Aceste forțe scad rapid cu distanța. Forțele de atracție și repulsie rezultate într-o manieră complexă depind de distanța dintre particule. La o anumită distanță este zero, la mai puțin de. repulsia moleculelor predomină, iar forțele atractive acționează între ele. Evident, situația. unde forța rezultantă este zero, corespunde unei valori minime a energiei potențiale a interacțiunii moleculelor. Dependența de distanța r între moleculele învecinate este prezentată în Fig. 2.
Dacă particulele de materie se aflau în repaus, atunci se va stabili o distanță între ele. care corespunde condiției echilibrului lor stabil, la care energia potențială a interacțiunii presupune o valoare minimă.
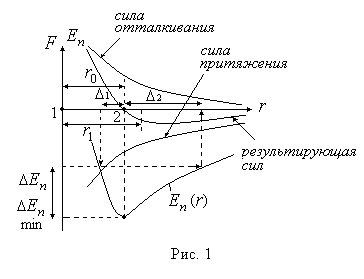
Totuși, particulele au energie cinetică. Prin urmare, se pot apropia de o anumită distanță. În acest caz, energia potențială crește cu. În cazul în care particula de forță repulsie 2 acte, și începe să se îndepărteze de primele particule trec poziție de echilibru având viteza maximă și îndepărtată la dreapta printr-o distanță. Energia cinetică a particulei 2 intră în energia potențială a interacțiunii, care este egală cu.
Deci, cum. atunci distanța medie dintre particulele învecinate va crește ().
Cu cât este mai mare mișcarea particulelor, cu cât este mai mare nivelul energiei lor cinetice, cu atât particula 2 poate fi mai apropiată de particula 1 (se presupune că este fixă).
Totuși, după ce se apropie, particula 2 se retrage din nou, dar la o distanță mai mare decât atunci când se apropie. Prin urmare, pe măsură ce crește temperatura, distanța medie dintre particulele de materie va crește, adică dimensiunile liniare ale corpurilor (și volumele lor) vor crește odată cu creșterea temperaturii. Motivul acestui fenomen este asimetria dependenței energiei potențiale de interacțiunea particulelor cu distanța dintre ele, așa cum se vede clar în Fig. 2.
Dacă intensitatea particulelor este foarte mare, atunci după apropierea lor, ei pot zbura atât de departe încât vor pierde atingerea. Apoi, putem spune că substanța a trecut într-o altă stare agregată, de exemplu, din solid a devenit lichidă sau gazoasă.
Pentru a ne imagina mai bine procesele de tranziție a materiei de la starea solidă la starea lichidă și apoi la starea gazoasă, este util să ne cunoaștem fig. 2. Pe ea, împreună cu dependența energiei potențiale a particulelor de materie pe distanța dintre ele sunt prezentate în nivelele fantomă cinetice de energie (valori medii) ale particulelor corespunzătoare statelor solide, lichide și gazoase ale substanței.
În stare gazoasă, toate particulele suferă o mișcare termică haotică (figura 3). În starea lichidă, fiecare particulă oscilează în jurul poziției de echilibru și trece periodic la noi poziții de echilibru, efectuând mișcări oscilatorii acolo (figura 4).
În stare solidă, fiecare particulă suferă mișcări termice vibrationale în apropierea unor poziții stabile de echilibru (figura 5). În modelul fizic considerat, sa presupus că particulele de materie sunt puncte materiale.
Cu toate acestea, atomii și moleculele constau din particule încărcate electric - un nucleu încărcat pozitiv și electroni încărcați negativ care se rotesc în jurul acestuia. Prin urmare, particulele la distanțe suficient de mici sunt atrase de forțele electrice, dar de îndată ce cochilii de electroni ai atomilor încep să se suprapună, apar forțe repulsive în creștere rapidă și particulele de materie sunt îndepărtate.